Białka transportujące
Dużą grupę białek stanowią białka transportujące, które przenoszą małe cząsteczki lub jony. Takimi białkami są, m.in.: przenosząca lipidy albumina, gromadząca i przenosząca żelazo transferyna oraz podstawowy nośnik tlenu molekularnego — hemoglobina. Hemoglobina jest białkiem występującym obficie w czerwonych krwinkach (erytrocytach) i to właśnie dzięki jej obecności możliwe jest zwiększenie stężenia tlenu molekularnego w płynach ustrojowych o prawie dwa rzędy wielkości w stosunku do ilości tlenu zawartego pod ciśnieniem atmosferycznym w wodzie. Warto bowiem zauważyć, że stężenie O2 w wodzie w temperaturze 36,5°C (temperatura ciała ludzkiego) i pod normalnym ciśnieniem atmosferycznym wynosi 2,1·10-4 mol/l, co stanowi zaledwie 1% zapotrzebowania organizmu na tlen. Strukturę cząsteczki hemoglobiny pokazano na rys. 33.
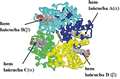
Rysunek 33. Struktura nieutlenowanej hemoglobiny. Zielona strzałka wskazuje hydrofobowe wnętrze cząsteczki, które zmienia swoje wymiary w miarę przyłączania lub oddysocjowania cząsteczek tlenu. Dla hemoglobiny w pełni utlenowanej wnętrze białka ma najmniejszą objętość. Struktura cząsteczki tego białka jest udostępniona przez PDB (kod 1A3N)
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Hemoglobina jest białkiem globularnym o prawie kulistym kształcie, masie molekularnej ok. 62 kDa i średnicy 5,5 nm. Jest przykładem białka powstałego w wyniku symetrycznego połączenia się dwóch identycznych podjednostek, z których każda zawiera po dwa różniące się nieco od siebie łańcuchy polipeptydowe. Łańcuchy te oznaczane są odpowiednio jako łańcuch α (141 aminokwasów) i łańcuch β (146 aminokwasów). Łańcuchy te oddziałują ze sobą za pośrednictwem wiązań niekonwalencyjnych tworząc charakterystyczny tetramer oznaczany jako α-β-α-β lub α2β2 (względnie jako zespół łańcuchów A, B, C, D w danych dostępnych poprzez PDB). Na rys. 33 poszczególne łańcuchy — domeny (A, B, C i D) zaznaczone są różnymi kolorami. Tetramer α2β2 ma dobrze ukształtowaną strukturę czwartorzędową — przestrzenną organizację domen o określonej strukturze trzeciorzędowej. Choć łańcuchy α i β różnią się między sobą długością oraz sekwencją aminokwasów, to jednak każdy z nich ma bardzo zbliżoną strukturę trzeciorzędowa i zawiera taką samą niebiałkową grupę — cząsteczkę hemu. Hem (będący bardzo dobrym barwnikiem) jest związkiem kompleksowym, w którym atom żelaza dwuwartościowego (Fe2+) znajdujący się w środku pierścienia porfirynowego tworzy wiązania koordynacyjne z czterema atomami azotu porfiryny. Atom żelaza może przyłączyć cząsteczkę O2 bez zmiany swojej wartościowości, tworząc tzw. utlenowaną formę hemoglobiny (zwaną też oksyhemoglobiną) o jasnoczerwonym kolorze. Przyłączanie tlenu jest odwracalne i zależy od ciśnienia cząstkowego tlenu w narządach.
Ze względu na obecność czterech grup hemowych, pojedyncza cząsteczka hemoglobiny może przenosić od jednej do czterech cząsteczek O2. Wiązanie tlenu przez hemoglobinę ma charakter kooperatywny, gdyż przyłączenie cząsteczki O2 do grupy hemowej jednego z łańcuchów ułatwia wiązanie się następnych cząsteczek tlenu z grupami hemowymi pozostałych łańcuchów. Taki mechanizm przyspiesza wychwyt O2 w środowisku bogatym w tlen. Natomiast w środowisku o niskiej zawartości tlenu, hemoglobina łatwo oddysocjowuje cząsteczki O2. Ta właściwość pozwala hemoglobinie szybko wiązać tlen w tkankach płuc i równie szybko go oddawać w tkankach obwodowych.
Białkiem spokrewnionym z hemoglobiną i także bardzo silnie wiążącym tlen jest mioglobina. Składa się ona z pojedynczego łańcucha polipeptydowego (153 aminokwasy) i tylko z jednej grupy hemowej. Będąc białkiem o strukturze monomerycznej, mioglobina nie posiada jednak zdolności kooperatywnego wiązania cząsteczek O2. Posiada też zdecydowanie inne właściwości związane z wychwytywaniem tlenu — chętniej wiąże tlen w środowisku o niskim stężeniu O2, niż w środowisku bogatym w tlen. Jej zadaniem jest magazynowanie tlenu w tkankach mięśni. Tlen ten jest wykorzystywany podczas wzmożonej aktywności mięśni.
Wiele wyspecjalizowanych białek transportujących funkcjonuje w błonach komórkowych gdzie tworzy selektywne kanały transportowe dla rozmaitych jonów, np. takich jak H+, Na+, K+ lub Ca2+. W szczególności, w błonach komórek mięśni znajdują się białka transportujące jony Ca2+, które są niezbędne dla wyzwolenia ich skurczu. Aktywny proces transportu jonów wapnia przez odpowiednie białko śródbłonowe wymaga dodatkowej energii, która czerpana jest z hydrolizy cząsteczki ATP. Dlatego białko tworzące kanał dla jonów wapnia jest także enzymem katalizującym hydrolizę ATP, skąd wynika jego nazwa — Ca2+ ATPaza. Przykładem białka będącego kanałem przepustowym dla cząsteczek prostych cukrów jest maltoporyna pokazana na rys. 18.





