Białka jako sekwencje aminokwasów
Niewielkie białka zawierają od kilkudziesięciu do kilkuset aminokwasów połączonych ze sobą w ramach jednego lub czasami kilku łańcuchów. Białka uważane za "duże" składają się z kilku tysięcy aminokwasów. Niezależnie od liczby zawartych aminokwasów, masy molekularne białek są znacznie większe od mas molekularnych typowych cząsteczek organicznych. Na przykład, masa stosunkowo niewielkiego białka, cytochromu c składającego się ze 104 aminokwasów, wynosi około 12,4 kDa (masa 1 Da odpowiada atomowej jednostce masy czyli 1/12 masy atomu izotopu węgla 12C; 1 Da = 1,66·10-27 kg).
Z chemicznego punktu widzenia białka są więc cząsteczkami o niezwykle różnorodnej i skomplikowanej budowie. Mają natomiast podobny skład chemiczny. W procentowym przeliczeniu na liczbę wszystkich atomów w białku, składają się one przede wszystkim z węgla (50 - 55%), tlenu (20 - 30%), azotu (14 - 18%), wodoru (6 - 7%) i siarki (do 2%). Niektóre białka zawierają również bardzo małe ilości innych pierwiastków, takich jak fosfor, wapń, żelazo, miedź, cynk, mangan, molibden i magnez.
Aminokwasy, podstawowe elementy struktur białkowych, są pochodnymi kwasów karboksylowych, w których atom wodoru w łańcuchu alifatycznym kwasu został zastąpiony przez grupę aminową. Aminokwasy są białymi, krystalicznymi ciałami rozpuszczalnymi w wodzie, ale nierozpuszczalnymi w alkoholu.
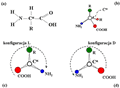
Rysunek 1. Budowa cząsteczki α-aminokwasu. a) Wzór strukturalny aminokwasu w postaci cząsteczkowej. R oznacza decydujący o właściwościach aminokwasu łańcuch boczny. b) Model przestrzenny cząsteczki aminokwasu: cztery podstawniki COOH, R, NH2 i H tworzą tetraedr wokół węgla Cα. c) Schematyczne przedstawienie aminokwasu w konfiguracji L: grupa COOH, łańcuch boczny R i grupa NH2 rozłożone są zgodnie z ruchem wskazówek zegara. Niewidoczny atom wodoru znajduje się ponad płaszczyzną rysunku. Na cząsteczkę patrzymy wzdłuż wiązania H-Cα. d) Konfiguracja D: lustrzane odbicie konfiguracji L.
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Wszystkie aminokwasy występujące w białkach ludzkich i zwierzęcych zawierają przynajmniej jedną grupę aminową (-NH2) i jedną grupę karboksylową (-COOH). Obie grupy dołączone są do tego samego atomu węgla zwanego atomem węgla α i oznaczanym jako węgiel Cα. Dlatego też aminokwasy te noszą nazwę α-aminokwasów. W pozostałych dwóch wiązaniach węgla Cα uczestniczą atom wodoru (H) i łańcuch boczny R, który jest inny dla każdego α-aminokwasu i decyduje o jego właściwościach. Wzór strukturalny cząsteczki α-aminokwasu (zwanego w dalszej części artykułu skrótowo aminokwasem) przedstawiony jest na rys. 1a. Wszystkie wiązania tworzone przez węgiel Cα mają charakter wiązań kowalencyjnych. Układ podstawników tworzy tetraedr, w środku którego znajduje się atom węgla Cα, zaś cztery podstawniki leżą w jego narożach (rys. 1b). Obecność asymetrycznego atomu węgla Cα połączonego z czterema różnymi podstawnikami jest powodem chiralności i aktywności optycznej aminokwasów. Chiralne związki chemiczne to takie, których cząsteczki zbudowane są z dokładnie takich samych atomów, natomiast ich struktury przestrzenne mają się do siebie tak, jak prawa i lewa ręka (z języka greckiego cheir — ręka). Dwie możliwe formy strukturalne (dwa izomery optyczne) aminokwasów przedstawione są schematycznie na rys. 1c i 1d. Na obu tych rysunkach patrzymy na cząsteczkę aminokwasu wzdłuż wiązania H-Cα, przy czym atom wodoru nie jest zaznaczony, gdyż znajduje się ponad płaszczyzną rysunku. Odmiana strukturalna, w której grupy karboksylowa, łańcuch boczny i grupa aminowa rozmieszczone są zgodnie z ruchem wskazówek zegara nosi nazwę konfiguracji L (rys. 1c). Odbicie lustrzane tej konfiguracji oznaczane jest jako konfiguracja D (rys. 1d). Podobnie jak wiele innych związków chemicznych mających swoje lustrzane odpowiedniki, aminokwasy o konfiguracji L i D mają identyczne właściwości chemiczne i fizyczne z jednym wyjątkiem — każda odmiana konfiguracyjna skręca płaszczyznę polaryzacji światła w innym kierunku. Z uwagi na bliźniacze podobieństwo mało jest metod fizycznych i chemicznych pozwalających na odróżnienie i rozdzielenie obu izomerów optycznych. Świat materii ożywionej rozróżnia je jednak bezbłędnie, gdyż w procesach biochemicznych zachodzących w organizmach żywych wykorzystywana jest odmiana aminokwasów o konfiguracji L. Dlatego też aminokwasy, z których zbudowane są naturalne białka występują w konfiguracji L, a czynniki odpowiedzialne za ten brak symetrii w świecie materii ożywionej nie są dobrze zrozumiane.
W środowisku obojętnym (pH = 7), aminokwasy występują w formie jonów obojnaczych, tzn. posiadają biegun dodatni i ujemny. W tej formie grupa aminowa przyłącza dodatkowy jon wodoru tworząc grupę -NH3+, zaś grupa karboksylowa oddysocjowuje jeden jon wodoru tworząc grupę -COO-. Wartość pH, od której zależy stan ładunkowy aminokwasu, zdefiniowana jest jako ujemny logarytm dziesiętny ze stężenia molowego jonów wodoru w roztworze (pH = - log[H+]). W warunkach zbliżonych do fizjologicznych pH jest bliskie 7. Wartości pH < 7 określają środowisko kwaśne, a wartości pH> 7 definiują środowisko zasadowe. W środowisku kwaśnym tworzy się jon dodatni aminokwasu: +H3NRHCOOH (grupa karboksylowa pozostaje niezjonizowana, zaś grupa aminowa występuje w postaci zjonizowanej -NH3+). Natomiast w środowisku o charakterze zasadowym powstaje jon ujemny: H2NRHCOO- (grupa aminowa pozostaje niezjonizowana, zaś grupa karboksylowa występuje w postaci zjonizowanej -COO-).
Aminokwasy mają złożoną strukturę chemiczną i na ogół identyfikuje się je według nazw zwyczajowych, a nie systematycznych. Zestawienie wybranych właściwości 20 aminokwasów występujących w naturalnych białkach przedstawiono w tabeli 1.
Tabela przedstawia nazwy aminokwasów oraz ich trzy- i jednoliterowe symbole. Kolejne kolumny tabeli przedstawiają częstość ich występowania w białkach, masy, punkt izoelektryczny i rok odkrycia — pełny zestaw aminokwasów był znany w 1932 r. Podane tu masy dotyczą stanu związanego w białku, natomiast punkt izoelektryczny (pHI) stanu swobodnego aminokwasu. Punkt izoelektryczny odpowiada takiej wartości pH, przy której wypadkowy ładunek aminokwasu jest równy zero. Właściwości elektryczne aminokwasów w białkach silnie zależą od konformacji białka. Lista aminokwasów podzielona jest w tabeli na trzy grupy: hydrofobowe, hydrofilowe nienaładowane i hydrofilowe naładowane w warunkach fizjologicznych. Nazwy te zostaną wyjaśnione w dalszej części artykułu.
W warunkach fizjologicznych 15 aminokwasów jest obojętnych elektrycznie, tzn. aminokwasy te mają momenty dipolowe, ale nie mają wypadkowego ładunku elektrycznego. Pięć aminokwasów jest naładowanych. Dwa z nich to naładowane ujemnie kwasy, a trzy to naładowane dodatnio zasady. Zasadowy charakter trzem aminokwasom nadają łańcuchy boczne.
Wzory chemiczne definiujące łańcuchy boczne aminokwasów przedstawione są na rys. 2. Schematyczne konfiguracje przestrzenne aminokwasów pokazane są natomiast na rys. 3. Na rysunku tym atomy tlenu zaznaczone są na czerwono, węgla na biało, azotu na niebiesko, siarki na żółto, a mające najmniejsze rozmiary atomy wodoru, nie są zaznaczone. Atomy siarki występują wyłącznie w cysteinie i metioninie.

Rysunek 2. Wzory strukturalne łańcuchów bocznych aminokwasów
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
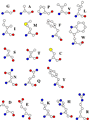
Rysunek 3. Ilustracja przestrzennego ułożenia atomów w aminokwasach
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Każdy aminokwas pełni w białku jakąś rolę. Dwa aminokwasy: glicyna i prolina często określają charakter struktury natywnej białka. Glicyna jest bowiem najmniejszym aminokwasem (jej łańcuch boczny to po prostu atom wodoru) i znaleźć ją można w elementach łączących typowe podstruktury białka. Są nimi tzw. struktury drugorzędowe, których budowa zostanie szerzej omówiona w dalszej części tego artykułu. Prolina jest w istocie nie aminokwasem, a cyklicznym iminokwasem (jedyny taki wyjątek wśród "aminokwasów"), gdyż zawiera niearomatyczny sztywny pierścień, do którego należy węgiel Cα. Pierścień ten trudno "upakować" i dlatego prolina często kończy lub zakrzywia struktury drugorzędowe. Największy aminokwas to tryptofan. Tryptofan jest jednym z trzech aminokwasów zawierających pierścień aromatyczny. Pozostałe dwa to fenyloalanina i tyrozyna, ale tylko tryptofan w znaczący sposób absorbuje światło o długości fali 280 nm, co z kolei prowadzi do fluorescencji. Badanie fluorescencji tryptofanu jest jedną z podstawowych metod pozwalających wnioskować o konformacji białka — fluorescencja jest silna, gdy tryptofan jest eksponowany (znajduje się na powierzchni cząsteczki białka), a słaba, gdy jest ściśle otoczony przez inne aminokwasy, a więc w stanie zwiniętym.
Organizm ludzki potrafi zsyntetyzować dwanaście z dwudziestu aminokwasów potrzebnych do budowy białek, pozostałe muszą być dostarczone z pożywieniem. Aminokwasy podstawowe, które organizm pobiera z pożywieniem noszą nazwę egzogennych. Natomiast te, które potrafi sam wytworzyć nazywają się aminokwasami endogennymi. Podstawowymi (egzogennymi) aminokwasami, które organizm ludzki musi pobrać przyswajając bogate w białko pożywienie są: lizyna, tryptofan, walina, histydyna, leucyna, izoalanina, fenyloalanina i treonina.
Istnieją również inne aminokwasy, które występują w przyrodzie lub są wytwarzane syntetycznie. Podstawowa różnica między tymi aminokwasami a α-aminokwasami występującymi w białkach ludzkich i zwierzęcych polega na tym, że grupy aminowa (-NH2) i karboksylowa (-COOH) nie są przyłączone do tego samego atomu węgla. Dotychczas wyodrębniono i zidentyfikowano ponad 150 takich odmiennych aminokwasów, występujących, m.in. w białkach niektórych grzybów oraz roślin wyższych.
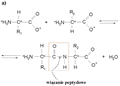
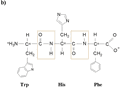
Rysunek 4. a) Powstawanie wiązania peptydowego w dipeptydzie. R1 i R2 oznaczają łańcuchy boczne aminokwasów biorących udział w reakcji kondensacji. W prostokącie zaznaczonym linią przerywaną znajduje się grupa atomów tworząca wiązanie peptydowe. b) Krótki łańcuch polipeptydowy — tripeptyd o sekwencji: tryptofan - histydyna - fenyloalanina
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W genetycznie uwarunkowanym procesie syntezy białek aminokwasy łączą się ze sobą kowalencyjnym wiązaniem peptydowym o energii około 4 eV. Odległość pomiędzy kolejnymi atomami węgla Cα w białku wynosi około 0,38 nm. Proces powstawania wiązania peptydowego pokazano na rys. 4a. W tej rekcji zjonizowana grupa karboksylowa (-COO-) jednego aminokwasu łączy się ze zjonizowaną grupą aminową (-NH3+) drugiego aminokwasu. Tworzy się charakterystyczne ugrupowanie atomów, ułożonych w jednej płaszczyźnie (-COHN-), zaznaczone na rys. 4a linią przerywaną. Wiązanie między atomem węgla grupy karbonylowej (-C=O) a atomem azotu grupy aminowej, o długości około 0,13 nm, ma częściowo charakter wiązania podwójnego, co decyduje o jego sztywności i tym samym utrudnia rotację łańcucha polipeptydowego. Rotacje są jednak dozwolone wokół dwóch wiązań przebiegających wzdłuż łańcucha wychodzących z węgla Cα. Procesowi powstania wiązania peptydowego towarzyszy wydzielenie się jednej cząsteczki wody. Jest to reakcja kondensacji, której równowaga przesunięta jest raczej w kierunku hydrolizy, a nie syntezy. Dlatego biosynteza białek polegająca na przyłączaniu kolejnych aminokwasów i wydłużaniu łańcucha wymaga dostarczenia dodatkowej energii. W komórkach proces ten zachodzi w wyspecjalizowanych organellach zwanych rybosomami .
Powstające w wyniku biosyntezy białka są na ogół długimi liniowymi polimerami aminokwasów i dlatego trudno jest przedstawić ich sumaryczny wzór chemiczny. Można to jednak zrobić dla krótkich polipeptydów. Przykład krótkiego liniowego polimeru — tripeptydu (Trp-His-Phe) z zaznaczonymi wiązaniami peptydowymi pokazano na rys. 4b.





