Zastosowanie metody EPR do bezpośredniej obserwacji kinetyki zwijania i rozwijania białka
Zasadniczy mechanizm fizyczny, na którym oparta jest metoda elektronowego rezonansu paramagnetycznego (EPR) jest zbliżony ideowo do opisanego wyżej jądrowego rezonansu magnetycznego. W odróżnieniu jednak od techniki NMR, która jest czuła na magnetyzm jądrowy, metoda EPR odnosi się do magnetyzmu spinów elektronowych. Za pomocą EPR wykrywa się zatem cząsteczki, atomy lub jony, które zawierają jeden lub więcej niesparowanych elektronów. Obiekty takie noszą nazwę centrów paramagnetycznych. Są nimi defekty strukturalne lub domieszki paramagnetyczne w ciałach stałych (np. jony metali przejściowych lub ziem rzadkich o częściowo zapełnionych podpowłokach elektronowych d lub f). Mogą być nimi także molekuły zawierające zerwane wiązania lub niesparowane elektrony (np. dobrze znane z chemii wolne rodniki organiczne lub nieorganiczne), a także molekuły organiczne o sparowanych spinach w stanie podstawowym, w których spinowy moment elektronowy wzbudzany jest na krótki czas na skutek pochłonięcia kwantu promieniowania elektromagnetycznego o energii wystarczającej dla "odwrócenia" spinu (cząsteczki we wzbudzonych światłem stanach trypletowych).
Niesparowany elektron wykazuje różny od zera spinowy moment pędu 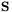 , któremu odpowiada elektronowy spinowy moment magnetyczny
, któremu odpowiada elektronowy spinowy moment magnetyczny 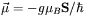 , gdzie
, gdzie 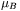 oznacza tzw. magneton Bohra o wartości 9,2732·10-24 JT-1, a
oznacza tzw. magneton Bohra o wartości 9,2732·10-24 JT-1, a 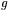 jest bezwymiarowym współczynnikiem proporcjonalności pomiędzy spinowym momentem pędu a momentem magnetycznym. Współczynnik
jest bezwymiarowym współczynnikiem proporcjonalności pomiędzy spinowym momentem pędu a momentem magnetycznym. Współczynnik 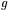 ma charakterystyczną wartość dla danego centrum paramagnetycznego. Spełnia on więc podobną funkcję jak współczynnik
ma charakterystyczną wartość dla danego centrum paramagnetycznego. Spełnia on więc podobną funkcję jak współczynnik 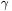 charakteryzujący dane jądro atomowe w wypadku NMR. Kwantowy obraz EPR jest analogiczny do kwantowego modelu NMR (przedstawionego na rys. 23). Dla najprostszego przypadku jakim jest jeden niesparowany elektron i przy braku innych oddziaływań (np. oddziaływań niesparowanego spinu elektronowego ze spinem jądrowym), warunek dla przejść rezonansowych w EPR w polu magnetycznym o natężeniu
charakteryzujący dane jądro atomowe w wypadku NMR. Kwantowy obraz EPR jest analogiczny do kwantowego modelu NMR (przedstawionego na rys. 23). Dla najprostszego przypadku jakim jest jeden niesparowany elektron i przy braku innych oddziaływań (np. oddziaływań niesparowanego spinu elektronowego ze spinem jądrowym), warunek dla przejść rezonansowych w EPR w polu magnetycznym o natężeniu 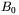 można zapisać następująco:
można zapisać następująco: 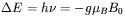 . Ze względu na fakt, że moment magnetyczny niesparowanego elektronu jest około 1000 razy większy od elementarnego jądrowego momentu magnetycznego, odpowiednie przejścia rezonansowe obserwuje się dla częstości o wartościach trzy rzędy wielkości wyższych niż dla NMR. Przykładowo, dla molekuł posiadających jeden niesparowany elektron (w chemii zwanych często wolnymi rodnikami), w polu magnetycznym około 0,35 T, przejście rezonansowe obserwowane jest przy częstości około 9,8 GHz, a więc w zakresie mikrofal. Odpowiednie przejście rezonansowe dla jąder wodoru (1H) w tym samym polu magnetycznym byłoby obserwowane przy częstości radiowej około 14,9 MHz.
. Ze względu na fakt, że moment magnetyczny niesparowanego elektronu jest około 1000 razy większy od elementarnego jądrowego momentu magnetycznego, odpowiednie przejścia rezonansowe obserwuje się dla częstości o wartościach trzy rzędy wielkości wyższych niż dla NMR. Przykładowo, dla molekuł posiadających jeden niesparowany elektron (w chemii zwanych często wolnymi rodnikami), w polu magnetycznym około 0,35 T, przejście rezonansowe obserwowane jest przy częstości około 9,8 GHz, a więc w zakresie mikrofal. Odpowiednie przejście rezonansowe dla jąder wodoru (1H) w tym samym polu magnetycznym byłoby obserwowane przy częstości radiowej około 14,9 MHz.
Uproszczony schemat blokowy spektrometru EPR pokazano na rys. 26. Należy zwrócić uwagę, że typowy spektrometr EPR rejestruje widmo w funkcji pola magnetycznego przy ustalonej częstości promieniowania mikrofalowego. Ze względu na sposób detekcji z zastosowaniem dodatkowej modulacji pola magnetycznego, typowe widmo EPR odpowiada pierwszej pochodnej sygnału absorpcji (amplituda linii widma osiąga wartości zerowe w punktach odpowiadających maksimum absorpcji).
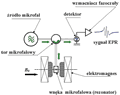
Rysunek 26. Schemat blokowy spektrometru EPR
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W przypadku badań materiałów biologicznych, metoda EPR ze względu na jej wysoką czułość pozwala pracować ze znacznie mniejszymi objętościami próbek, niż ma to miejsce w spektroskopii NMR. Należy jednak zwrócić uwagę na to, że w większości przypadków białka nie zawierają niesparowanych elektronów i nie mogą być badane za pomocą techniki EPR. Tylko niewielka grupa białek zawierających atomy metali grupy przejściowej, takich jak Fe, Cu, Mn lub Co, o częściowo wypełnionej wewnętrznej powłoce d, wykazuje obecność trwałego spinowego momentu magnetycznego. Z reguły jednak, w warunkach zbliżonych do fizjologicznych, tzn. w temperaturze około 300 K oraz dla typowych "fizjologicznych" stężeń, białka takie nie są wykrywalne metodą EPR ze względu na znaczne poszerzenie linii rezonansowych. Dlatego też, w celu wykorzystania walorów metody EPR do badań dynamiki molekuł białka, stosuje się pewien dodatkowy zabieg zwany znakowaniem spinowym. Polega on na przyłączeniu do badanego białka w drodze reakcji chemicznej znacznika spinowego, dodatkowej, na ogół niewielkiej, cząsteczki zawierającej trwały spinowy moment magnetyczny. Takimi cząsteczkami są m.in. organiczne rodniki zawierające grupę NO· (symbol "·"oznacza tu niesparowany elektron). Mechanizm przyłączania znacznika spinowego do cząsteczki białka pokazano schematycznie na rys. 27.
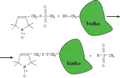
Rysunek 27. Schematyczne przedstawienie techniki znakowania spinowego białek. Znacznik spinowy (MTSSL) przyłączany jest do grupy tiolowej reszty aminokwasowej cysteiny
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W znakowaniu spinowym wykorzystuje się najczęściej jeden z naturalnie występujących w białku aminokwasów, cysteinę. Jak już wspomniano, aminokwas ten zawiera grupę tiolową -SH. Ten właśnie fragment reszty aminokwasowej wykorzystywany jest do przyłączenia cząsteczki znacznika spinowego. Mechanizm reakcji prowadzi do powstania mostka dwusiarczkowego (-S-S-) pomiędzy cysteiną a znacznikiem spinowym. Jeśli cysteina nie jest "dostępna" w danym białku, metodami inżynierii genetycznej mutuje się białko. Pozwala to na umieszczenie cysteiny w określonym położeniu w ramach łańcucha polipeptydowego. Dla niektórych niewielkich białek globularnych tą drogą udało się wprowadzić znacznik spinowy w bardzo wiele położeń bez jednoczesnej destabilizacji struktury trzeciorzędowej białka. Na przykład, Mchaourab wprowadził znaczniki spinowe w ok. 50 różnych położeń w tak niewielkim białku, jakim jest lizozym T4L (164 aminokwasy, masa molekularna 18,6 kDa). Na rys. 28 zestawiono widma EPR uzyskane dla znakowanego spinami lizozymu T4L. Wyraźnie poszerzone widmo (linia ciągła) odpowiada zwiniętej formie białka. Zawężone widmo (linia przerywana) odpowiada białku rozwiniętemu. Białko rozwinięto mieszając jego wodny roztwór z czynnikiem denaturującym — chlorowodorkiem guanidyny (GdnHCl). Końcowe stężenie GdnHCl wynosiło 4 mol/l. Oba widma na rys. 28 odpowiadają dokładnie tej samej ilości rejestrowanych spinów. Różnice w kształcie widm wynikają wyłącznie z odmiennej dynamiki spinu-znacznika przyłączonego do rozwiniętej i zwiniętej formy białka. W przypadku białka rozwiniętego znacznik spinowy silnie oddziałuje z roztworem i dzięki szybszej rotacji linie EPR ulegają zawężeniu. Przeciwnie, dla białka zwiniętego, ruch znacznika jest spowolniony, gdyż w znacznym stopniu reprezentuje on dynamikę zwiniętej, globularnej struktury białka.
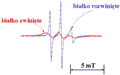
Rysunek 28. Widma EPR dla zwiniętego i rozwiniętego lizozymu T4L zarejestrowane w postaci pierwszej pochodnej sygnału absorpcji w funkcji natężenia pola magnetycznego. Białko było znakowane znacznikami spinowymi (MTSSL). Formę rozwiniętą białka uzyskano po dodaniu czynnika denaturującego (GdnHCl). Końcowe stężenie GdnHCl wynosiło 4 mol/l.
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Na rys. 29 pokazano rozmieszczenie znaczników spinowych w cząsteczce lizozymu T4L. Znaczniki zostały umieszczone w następujących miejscach łańcucha polipeptydowego: 131 (walina) i 151 (treonina). Aby przyłączyć znaczniki MTSSL oba aminokwasy zostały uprzednio zamienione na cysteinę. Obecność dwóch znaczników w tym białku, zlokalizowanych na sąsiadujących ze sobą α-helisach, jest źródłem dodatkowego poszerzenia linii EPR (tzw. poszerzenie "dipol-dipol") dla struktury zwiniętej.

Rysunek 29. Struktura molekuły lizozymu T4L znakowanego spinowo znacznikami MTSSL. Dla lepszego zobrazowania lokalizacji spinów molekuła białka przedstawiona jest w modelu upakowania poszczególnych aminokwasów (lewa strona rysunku) oraz w postaci "wstążki" (prawa strona rysunku)
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Podwójne znakowanie spinami wykorzystuje się, m.in., do mierzenia odległości pomiędzy poszczególnymi fragmentami struktury białka. Bardzo duże różnice w kształcie widm dla znakowanego spinowo białka zwiniętego i rozwiniętego wyraźnie sugerują możliwość zastosowania metody EPR do kinetycznych badań konformacji białek.
Badania dynamiki procesu zwijania i rozwijania molekuł białka mogą być przeprowadzane w stosunkowo wygodny sposób za pomocą metody EPR po sprzęgnięciu jej z techniką szybkiego przepływu i mieszania substratów. Jednym z podstawowych warunków udanego eksperymentu przeprowadzonego za pomocą techniki przepływowego EPR jest umieszczenie mieszacza substratów możliwie blisko rezonatora mikrofalowego, tak aby czas przemieszczania się mieszaniny substratów do rezonatora był jak najkrótszy.
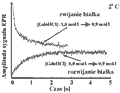
Rysunek 30. Obserwacja za pomocą techniki EPR procesu zwijania i rozwijania cytochromu c. Białko znakowane znacznikiem MTSSL w pozycji 102. Proces zwijania białka inicjowany był skokową zmianą stężenia czynnika denaturującego (GdnHCl) z 1,8 do 0,9 mol/l. Proces rozwijania zapoczątkowano skokową zmianą stężenia GdnHCl z poziomu 0,0 do 0,9 mol/l. W celu spowolnienia procesów, zwijanie i rozwijanie obserwowane były w temperaturze 2°C
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Wyniki obserwacji procesu zwijania i rozwijania małego białka za pomocą metody przepływowego EPR pokazano na rys. 30. Badanym białkiem był cytochrom c wyhodowany w komórkach drożdży. Cytochrom c jest białkiem często występującym w mitochondriach komórek zwierzęcych, a zwłaszcza w tkankach mięśni serca. Białko to składa się z pojedynczego łańcucha polipeptydowego liczącego 104 aminokwasy. W swej strukturze cytochrom c zawiera także grupę prostetyczną, którą jest cząsteczka hemu. Masa molekularna tego białka wynosi 12,4 kDa. Białko znakowano znacznikiem MTSSL w pozycji 102, czyli w miejscu naturalnie występującej cysteiny. Proces zwijania białka inicjowany był skokową zmianą stężenia czynnika denaturującego (GdnHCl) z 1,8 do 0,9 mol/l. Proces rozwijania był natomiast zapoczątkowany skokową zmianą stężenia GdnHCl z poziomu 0,0 do 0,9 mol/l. Dla spowolnienia procesów, kinetykę zwijania i rozwijania obserwowano w obniżonej temperaturze (2°C). W tych warunkach proces zwijania cytochromu c przebiega dwustopniowo. Jedna składowa ma stałą czasową 0,084 s, a druga, wolniejsza, przebiega ze składową czasową 0,83 s. Ten dwustanowy przebieg zwijania się białka tłumaczono powstaniem formy częściowo zwiniętej, dla której dalszy proces zwijania był na moment zablokowany przez "niewłaściwe" wzajemne położenie płaszczyzny hemowej oraz pierścienia imidazolowego jednej z histydyn (His26 lub His33). Proces rozwijania zachodził jednostopniowo i był wolniejszy, przebiegając ze stałą czasową około 0,7 s.
Zespolenie technik przepływowych z metodą EPR oferuje szereg istotnych korzyści w przypadku badania procesów dynamicznych w białkach. Możliwość umieszczania znaczników spinowych wybiórczo w różnych, "strategicznie" znaczących miejscach białka dostarczyć może bardzo istotnych, lokalnych informacji o procesach dynamiki zwijania i rozwijania cząsteczek białkowych. Natomiast metody optyczne, takie jak spektrofotometria absorpcyjna i fluorescencyjna, czy dichroizm kołowy, lepiej nadają się do śledzenia procesów globalnych.





