Oddziaływania między aminokwasami w białku
Fizyczną przyczyną zwijania się białek do postaci globularnej jest istnienie wzajemnych oddziaływań między aminokwasami oraz oddziaływań aminokwasowych łańcuchów bocznych z cząsteczkami rozpuszczalnika (wody). W wypadku białek są to złożone oddziaływania, w których dominuje charakter przyciągający, ale nie musi tak być w wypadku przypadkowych heteropolimerów. Najsilniejsze wiązania w białku to wiązania kowalencyjne. Są to przede wszystkim wiązania peptydowe (o energii rzędu 4 eV), które cementują aminokwasy ze sobą, ale nie ustalają struktury drugorzędowej i trzeciorzędowej białka. Wiązania kowalencyjne mogą się jednak pojawiać także w innych miejscach niż łańcuch polipeptydowy — w tzw. kontaktach. Mówimy, że aminokwasy tworzą ze sobą kontakt, jeśli są blisko siebie w przestrzeni, ale nie są swymi sąsiadami wzdłuż łańcucha. Oddziaływania kowalencyjne mogą się w kontakcie pojawić, ale tylko wtedy, gdy kontakt tworzą dwie cysteiny. Łańcuch boczny cysteiny kończy się grupą tiolową -SH. Dwie grupy tiolowe mogą łączyć się ze sobą tworząc tzw. mostek dwusiarczkowy. Jednak cysteina jest jednym z najrzadziej występujących aminokwasów i stąd obecność mostków dwusiarczkowych może co najwyżej tylko wspomagać zwijanie się białek.
Oddziaływania elektrostatyczne między naładowanymi aminokwasami są o rząd wielkości słabsze od wiązań kowalencyjnych. Mają one charakter zarówno przyciągający jak i odpychający w zależności od rodzaju aminokwasów. Oddziaływania tego typu nie mogą więc być samodzielnie odpowiedzialne za zwijanie, tym bardziej, że dotyczą one, w warunkach fizjologicznych, tylko pięciu polarnych aminokwasów. Oddziaływania te wnoszą jednak swój wkład do zmian konformacji cząsteczki białka przy zmienianiu wartości pH. Są one bowiem długozasięgowe, a efektywny potencjał oddziaływania elektrostatycznego zależy od pH.
W latach 30-tych A.E. Mirsky i L.C. Pauling zaproponowali, że kluczową siłą odpowiedzialną za zwijanie się białek powinny być wiązania wodorowe, których energia jest średnio 20 razy mniejsza od energii wiązań peptydowych. Istnieją dwa składniki oddziaływań wodorowych. Pierwszy to przesuwanie się gęstości chmury elektronowej z atomu o mniejszym ładunku jądra atomowego, np. wodoru, w stronę cięższego atomu, o większym ładunku jądra, np. tlenu. Prowadzi to do zaistnienia wypadkowego efektywnego ułamkowego ładunku (dodatniego na atomie wodoru). Drugi składnik to oddziaływanie elektrostatyczne pomiędzy takimi efektywnymi ładunkami, jak to ilustruje rysunek 5. Oddziaływania wodorowe są odpowiedzialne również za istnienie struktury podwójnej helisy DNA. W białkach wiązania wodorowe odgrywają kluczową rolę w powstawaniu i stabilizacji ich struktur przestrzennych.

Rysunek 5. Geometria przykładowego wiązania wodorowego
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Grupy atomów -C=O i -NH występujące wzdłuż łańcucha polipeptydowego białka mają ujemny ładunek na atomie tlenu i dodatni na atomie wodoru. Umożliwia to powstanie wiązań wodorowych pomiędzy tymi grupami. Segmenty białek stabilizowane przez wiązania wodorowe noszą nazwę struktur drugorzędowych. Są to α-helisy, struktury β i skręty. Istnienie tych struktur przewidzieli Pauling, R. Corey i H. Branson w badaniach modelowych.
Jednak w latach 50-tych W. Kauzmann wykazał, że same tylko wiązania wodorowe między aminokwasami nie są w stanie wytłumaczyć procesów zwijania się białek. Istnieją bowiem równie silne wiązania wodorowe aminokwasów z cząsteczkami otaczającej wody oraz pomiędzy samymi cząsteczkami wody. Aminokwasy hydrofilowe z tab. 1 to takie, które chętnie wiążą się z cząsteczką wody poprzez wiązanie wodorowe. Sytuację tę ilustruje rysunek 6 w odniesieniu do czysto hydrofilowego polimeru (który nie jest białkiem).
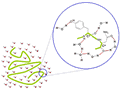
Rysunek 6. Zachowanie się polimeru złożonego z elementów hydrofilowych w wodzie. W powiększeniu pokazany jest fragment szkieletu polipetydowego zawierający dwa hydrofilowe łańcuchy boczne: tyrozyny i asparginy. W łańcuchu głównym naszkicowanym schematycznie zielonymi kreskami zaznaczono tylko grupy -NH-, atomy węgla Cα oraz atomy tlenu należące do grupy karbonylowej. Czerwoną przerywaną kreską zaznaczone są wiązania wodorowe, tworzone przez cząsteczki wody z atomami należącymi do szkieletu polipeptydowego i z atomami łańcuchów bocznych aminokwasów
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Aminokwasy hydrofobowe to takie, które wody unikają. Segmenty hydrofobowe nie tworzą wiązań wodorowych z cząsteczkami wody, ale w pobliżu takiego segmentu same cząsteczki wody wykazują tendencję do korelowania swych orientacji poprzez wzajemne oddziaływania wodorowe. Asocjacja segmentów hydrofobowych powoduje zmniejszenie powierzchni eksponowanej na wodę i tym samym zwiększenie entropii (możliwości ustawień konformacyjnych) otaczającej wody, co obniża energię swobodną ukladu. Segmenty hydrofobowe mają więc tendencję do unikania cząsteczek wody, gdyż w ten sposób maksymalizowana jest objętość obszaru o skorelowanych orientacjach cząsteczek wody. Prowadzi to do wystąpienia efektywnego wzajemnego przyciągania między aminokwasami hydrofobowymi. Przyciąganie to nosi nazwę oddziaływania hydrofobowego i ono właśnie, według Kauzmanna, stanowi najsilniejszy mechanizm odpowiedzialny za zwijanie. Łańcuch aminokwasów musi mieć dostateczną liczbę aminokwasów hydrofobowych, by móc stać się białkiem globularnym. Zrozumienie szczegółów molekularnych oddziaływań hydrofobowych pozostaje przedmiotem aktualnych badań.
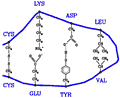
Rysunek 7. Przykłady oddziaływań pomiędzy łańcuchami bocznymi aminokwasów w białkach. Mostki dwusiarczkowe, oddziaływania jonowe, wodorowe i hydrofobowe zilustrowane są kolejno od lewej do prawej strony
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Oddziaływania tu omówione są schematycznie zilustrowane na rysunku 7. Istnieją jednak i inne oddziaływania, na przykład polaryzacyjne typu van der Waalsa (100 razy słabsze od wiązań peptydowych). Wszelkie wyżej wymienione oddziaływania dotyczą bardzo wielu par oddziaływujących ze sobą atomów. Zredukowanie ich do efektywnych oddziaływań pomiędzy całymi aminokwasami o środku mieszczącym się w położeniu węgla Cα nie jest zadaniem prostym zwłaszcza, że ważne są też oddziaływania z rozpuszczalnikiem.
W tabeli 3 przedstawiono typowe wartości energii wiązań międzyatomowych występujących w białkach począwszy od najsilniejszych, jakimi są wiązania kowalencyjne, przez jonowe i wodorowe, aż do najsłabszych — wiązań van der Waalsa. Energie wiązań podano w najczęściej stosowanych w chemii i biochemii jednostkach: kcal/mol oraz kJ/mol. Dodatkowo, w ostatniej kolumnie, podano wartości energii wiązań w jednostkach typowo fizycznych (eV), w przeliczeniu na pojedyncze wiązanie.
Współzawodnictwo pomiędzy energią oddziaływania wiązań wodorowych we wnętrzu białka i entropią faworyzującą stan rozwinięty prowadzi do "delikatnej" równowagi, w której lekko przeważa energia stanu zwiniętego (o około 40 kJ/mol). Ten niewielki margines stabilności jest także warunkiem spełniania funkcji biologicznych przez białka, gdyż ich właściwości katalityczne wiążą się często z zmianami konformacyjnymi. Ponadto mała stabilność termodynamiczna białek (podatność na denaturację) ułatwia ich rozkład i wymianę w procesach metabolicznych zachodzących w komórkach.





