Procesy enzymatyczne
Prawie 50% wszystkich białek występujących w komórkach to wyspecjalizowane katalizatory — enzymy, z których każdy katalizuje jedną określoną reakcję. Reakcje katalizowane przez enzymy są na ogół sprzężone, tak że produkt jednej reakcji staje się materiałem wyjściowym dla kolejnego procesu. Enzymy odznaczają się wysoką elastycznością działania, która polega na ścisłym uzależnieniu ich aktywności od stanu komórki. Dzięki temu możliwe są procesy regulujące, które adaptują metabolizm komórki do stale zmieniających się warunków zewnętrznych. Enzymy wydajnie obniżają energie aktywacji substratów, zwiększając tym samym prawdopodobieństwo zachodzenia procesów chemicznych. W obecności enzymów wiele reakcji chemicznych zachodzi znacznie szybciej (często nawet 1010 razy) niż w obecności katalizatorów syntetycznych. Dlatego też organizmy żywe mogą wytwarzać substancje, których otrzymanie w procesach technicznej syntezy jest albo niemożliwe, albo bardzo trudne.
Przykładem substancji wytwarzanej z dużą wydajnością w komórkach żywych, a trudnej do otrzymania na drodze syntezy chemicznej jest tlenek azotu (NO). NO jest małą molekułą nieorganiczną, która spełnia wiele funkcji regulujących w komórkach i tkankach. W szczególności, jest on odpowiedzialny za regulację ciśnienia tętniczego, gdyż bierze udział w mechanizmie rozluźniania mięśni gładkich wyścielających tętnice i żyły. Cząsteczki NO grają także bardzo ważną rolę w przekazywaniu sygnałów w komórkach nerwowych. Obecność tlenku azotu jest również niezbędna w procesie regulacji krzepliwości krwi. W pewnych warunkach jednak, zwiększone i niekontrolowane stężenie tlenku azotu może być zagrożeniem dla różnych struktur komórkowych, gdyż cząsteczka NO wykazuje bardzo duże powinowactwo chemiczne do wielu białek, w szczególności do enzymów zawierających hemowe grupy prostetyczne. Toksyczne są także produkty przemian NO, gdyż w środowisku komórki łączy się on łatwo z niektórymi reaktywnymi formami tlenu (np. O2-) wytwarzając w rezultacie jeden z najsilniejszych komórkowych utleniaczy — ONOO-.
Należy podkreślić, że gazowy NO jest także silnie toksyczny przy wdychaniu. Jest on składnikiem spalin samochodowych, gdyż jest wytwarzany (w niewielkich ilościach) z podstawowych składników powietrza — tlenu i azotu — w wyniku działania wysokich temperatur i ciśnień panujących w silnikach spalinowych.
Synteza NO w żywych komórkach zachodzi w warunkach fizjologicznych, a więc w stosunkowo niskiej temperaturze i pod normalnym ciśnieniem. Jest to możliwe dzięki istnieniu wyspecjalizowanego enzymu zwanego syntazą tlenku azotu (ang. nitric oxide synthase — w skrócie NOS). Enzym ten jest białkiem globularnym średniej wielkości i masie cząsteczkowej około 45 kDa. Jego łańcuch polipeptydowy składa się z 388 aminokwasów. Syntaza tlenku azotu zawiera też grupę prostetyczną — pojedynczą grupę hemową. NOS syntetyzuje tlenek azotu wykorzystując dwa substraty: bogaty w azot aminokwas — argininę oraz rozpuszczony w płynie komórkowym tlen molekularny (O2). Schemat komórkowej (endogennej) syntezy NO przedstawiono na rys. 31. W procesie tym bierze także udział inny enzym — kalmodulina, która zapoczątkowuje ciąg reakcji przechwytując "sygnałowy" kation wapnia (Ca2+). Aktywnym nośnikiem energii w procesie syntezy tlenku azotu jest cząsteczka fosforanu dinukleotydu nikotynoamidoadeninowego w formie zredukowanej (NADPH), która po odszczepieniu jonu wodorkowego (H-) przechodzi do formy utlenionej (NADP+). Obok tlenku azotu, w procesie katalizowanym przez NOS wytwarzany jest także inny aminokwas — cytrulina. Cytrulina jest jednym z tych α-aminokwasów, które choć często pojawiają się w komórkach w wyniku różnych przemian metabolicznych, nie wchodzą jednak w skład cząsteczek białka.
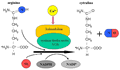
Rysunek 31. Synteza tlenku azotu w komórkach. Atom azotu uzyskiwany jest z aminokwasu — argininy, zaś atom tlenu z molekuły O2
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Działanie NOS, wyspecjalizowanego i występującego w kilku odmianach enzymu, silnie zależy od stanu komórki. W określonych warunkach NOS może wydajnie produkować tlenek azotu nie tylko w celach regulacji napięcia mięśni lub na potrzeby przekazywania chemicznych sygnałów miedzy komórkami, ale także w celu neutralizacji toksyn wytwarzanych przez bakterie.
Wyizolowanie tlenku azotu jako najsilniejszej endogennej substancji rozszerzającej naczynia krwionośne oraz wytłumaczenie procesów komórkowych prowadzących do jego syntezy jest wynikiem prac trzech niezależnych od siebie grup badawczych kierowanych przez R.F. Furchgotta, F. Murada i L.J. Ignarro. Rezultaty tych badań otworzyły drogę do stworzenia wielu nowych leków, w tym leków działających przeciwko nadciśnieniu tętniczemu (leki te nasilają endogenną syntezę tlenku azotu).
Ważną grupą procesów enzymatycznych zachodzących w żywych komórkach są procesy kataboliczne, w których złożone i bogate w energię substraty rozkładane są na proste cząsteczki w celu uzyskania energii. Dzięki enzymom, proces uwalniania energii zmagazynowanej w wiązaniach chemicznych substratów, np. cukrów, nie zachodzi gwałtownie, tak jak w zwyczajnej reakcji spalania, lecz odbywa się stopniowo. W wyniku tego, energia uzyskana z całkowitego rozkładu cukrów i utlenienia ich do końcowych produktów, jakimi są dwutlenek węgla (CO2) i woda (H2O), może być w pełni "zmagazynowana" w wysokoenergetycznych wiązaniach chemicznych aktywnych nośników energii — cząsteczek takich jak ATP (adenozyno-5’-trifosforan) lub wspomniany już wyżej NADPH.
Cząsteczki ATP są głównymi przenośnikami energii chemicznej w komórkach. ATP zawiera dwa wysokoenergetyczne wiązania z grupami fosforanowymi (-PO32-). Kiedy w komórce zachodzi potrzeba pobrania "zmagazynowanej" energii, w korzystnym energetycznie procesie hydrolizy od cząsteczki ATP odłączana jest grupa fosforanowa. Zależnie od warunków wewnątrz komórki, reakcja ta dostarcza od 46,0 do 54,4 kJ/mol użytecznej energii. Substratem wykorzystywanym w syntezie ATP jest cząsteczka-prekursor, czyli ADP (adenozyno-5’-difosforan). Cząsteczka ATP powstaje w wyniku przyłączenia jednej grupy fosforanowej pochodzenia nieorganicznego do cząsteczki ADP. Reakcja syntezy ATP wymaga dostarczenia energii z dodatkowego, zewnętrznego źródła. W przypadku komórek roślinnych oraz niektórych bakterii, zewnętrznym źródłem energii jest światło słoneczne, a mechanizmem odpowiedzialnym za jej pobieranie jest proces fotosyntezy. W komórkach zwierzęcych, ta dodatkowa energia uzyskiwana jest w procesie utleniania substancji pokarmowych w komórkowym łańcuchu oddechowym. Większość energii pochodzącej z rozkładu cząsteczek pokarmu jest uzyskiwana i przetwarzana w końcowym ogniwie łańcucha oddechowego — w procesach enzymatycznych zachodzących w wewnętrznych błonach mitochondriów. Mitochondria są tymi organellami, w których zużywany (redukowany) jest prawie cały tlen pobierany przez komórki. W wyniku redukcji tlenu w mitochondriach uzyskiwana jest energia potrzebna dla syntezy ATP.
W procesie polegającym na transferze elektronów do wnętrza mitochondriów oraz na wytworzeniu przeciwnie skierowanego gradientu stężenia jonów wodorowych (H+) bierze udział około czterdziestu białek. Ostatnim ogniwem przepływu elektronów uzyskiwanych z utleniania substancji pokarmowych, a także kluczowym elementem podtrzymującym gradient jonów wodorowych w poprzek błony mitochodrialnej, jest kompleks białka środbłonowego zwanego oksydazą cytochromową. Schemat kompleksu białkowego oksydazy cytochromowej pokazany jest na rys. 32.
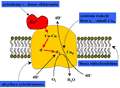
Rysunek 32. Schemat działania kompleksu cytochrom c-oksydaza cytochromowa — ostatniego ogniwa przepływu elektronów w komórkowym łańcuchu oddechowym. Oksydaza cytochromowa jest osadzona w wewnętrznej błonie mitochodrialnej. Czerwone strzałki pokazują kierunek przepływu elektronów od cytochromu c (donora elektronów) do centrum reakcji: hem a3-miedź CuB
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Oksydaza cytochromowa jest stosunkowo dużym białkiem o masie cząsteczkowej wynoszącej około 160 kDa. Białko to zawiera cztery grupy prostetyczne: dimer miedziowy Cu-Cu, dwie grupy hemowe a i a3 oraz centrum reakcji z atomem miedzi (CuB). Oksydaza cytochromowa katalizuje przepływ elektronów od innego białka — cytochromu c do końcowego receptora — tlenu molekularnego (O2). Na rys. 32 cząsteczka cytochromu c zaznaczona jest kolorem czerwonym. Cytochrom c, donor elektronów, także zawiera grupę prostetyczną — pojedynczą grupę hemową. W czasie transferu elektronów do oksydazy cytochromowej, hemowy atom żelaza w cytochromie c cyklicznie zmienia swoją wartościowość, ulegając na zmianę utlenianiu i redukcji (Fe2+ ↔ Fe3+). W wyniku takich czterech cykli, cytochrom c przekazuje kolejno cztery elektrony do grup prostetycznych oksydazy cytochromowej. W uproszczonym zapisie proces ten można przedstawić następująco:4 cyt c (Fe2+) + 4 H+ + O2 → 4 cyt c (Fe3+) + 2 H2O, gdzie cyt c (Fe2+) i cyt c (Fe3+) oznaczają, odpowiednio, zredukowany i utleniony cytochrom c. Zakłada się, że przepływ elektronów pomiędzy kolejnymi grupami prostetycznymi następuje w wyniku efektu tunelowania, gdyż zarówno grupy hemowe a i a3, jak i jony miedzi ukryte są wewnątrz oksydazy cytochromowej. W tzw. centrum reakcji, złożonym z hemu a3 i z atomu miedzi CuB, oksydaza cytochromowa przechwytuje i "przetrzymuje" cząsteczkę O2 aż do momentu zgromadzenia wspomnianych wyżej czterech elektronów. W wyniku redukcji tlenu molekularnego i przyłączenia pobranych ze środowiska wodnego czterech protonów powstają dwie cząsteczki wody. Transferowi elektronów od cytochromu c do centrum reakcji w oksydazie cytochromowej towarzyszy przepływ protonów (H+) w kierunku przeciwnym. "Pompowanie" H+ jest możliwe dzięki zmianom konformacji oksydazy cytochromowej wywołanym dopływem energii wytwarzanej w procesie dołączania elektronów do cząsteczki O2. Po obu stronach błony mitochondrialnej powstaje więc elektrochemiczny gradient stężenia protonów, przy czym różnica stężeń wynosi około 3 w jednostkach pH. To właśnie gradient H+ jest czynnikiem aktywującym kolejny enzym, syntazę ATP. Tak więc, nadmiar energii uzyskiwany w enzymatycznie kontrolowanym procesie łączenia jonów wodorowych z tlenem wykorzystywany jest następnie w procesie syntezy uniwersalnego komórkowego nośnika energii — cząsteczki ATP.





