Struktury drugorzędowe
Struktura pierwszorzędowa, czyli sekwencja aminokwasów determinuje natywną strukturę zwiniętą, czyli strukturę trzeciorzędową. W szkielecie wiązań łączących kolejne atomy węgla Cα w konformacjach natywnych rozpoznać można regularne motywy zwane strukturą drugorzędową, złożone ze struktur β, α-helis i skrętów. Są one stabilizowane przede wszystkim przez wiązania wodorowe. W α-helisie przypada 3,6 aminokwasu na pełen obrót. Istnieją i inne rodzaje helis, ale występują one rzadziej.
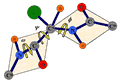
Rysunek 8. Kąty definiujące kształt szkieletu białka
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Jeden ze sposobów zidentyfikowania struktury przestrzennej białka polega na określeniu wartości kolejnych kątów dwuściennych: ψ i φ, jakie tworzą wiązania uczestniczące w budowie łańcucha głównego czyli szkieletu białka. Kąty te są zdefiniowane na rys. 8. Kolejny kąt, ω, również zdefiniowany na rys. 8, jest niemal zawsze bliski 180°, gdyż w wiązaniu peptydowym atomy Cα, C, O, N, H, oraz następny Cα leżą w jednej płaszczyźnie. Wszystkie wartości kątów ψ i φ znalezione w białkach można umieścić zbiorczo na płaszczyźnie ψ i φ, co nosi nazwę wykresu Ramachandrana. Okazuje się, że na wykresie Ramachandrana występują dwa silne zagęszczone obszary. W pierwszym z nich φ = -100 ± 50° i ψ = 120 ± 40°. Odpowiada to strukturom β. W drugim φ = -70 ± 40° i ψ = -50 ± 40°, co odpowiada α-helisom. Wykres Ramachandrana jest pokazany na rys. 9.
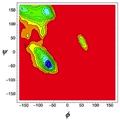
Rysunek 9. Wykres Ramachandrana pokazuje dozwolone wartości kątów dwuściennych ψ i φ występujących w α-helisach i strukturach β typowego polipeptydu
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Rys. 10 przedstawia ułożenie atomów w α-helisie. Wiązania wodorowe łączą w niej monomer i z monomerem i + 4. Struktura β powstaje z połączenia nici β za pomocą wiązań wodorowych. Nici te mogą przebiegać względem siebie równolegle bądź antyrównolegle w zależności od tego, jak przebiega łańcuch główny białka na zewnątrz obszaru badanej struktury β (rys. 10).
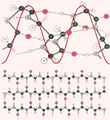
Rysunek 10. Budowa atomowa wybranych struktur drugorzędowych. Górna część rysunku przedstawia α-helisę, a dolna strukturę β zbudowaną z trzech antyrównoległych nici β
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W schematycznych wykresach struktur trzeciorzędowych białek, nici β zaznacza się często ukierunkowaną płaską strzałką, o zwrocie od końca aminowego do końca karboksylowego białka. Helisy natomiast przedstawia się w postaci zwiniętych wstążeki. Rys. 11 obrazuje przykłady struktur białek. Białka zazwyczaj zawierają zarówno α-helisy, jak i struktury β. Istnieją jednak białka tylko o jednym rodzaju struktury drugorzędowej.






