ROZDZIAŁ 8. SUPLEMENT 2
ISTOTA WIĄZANIA CHEMICZNEGO
Plik pdf do wydruku: r8_supl2.pdf
Przypadek H
Weźmy pod uwagę najprostszy układ dwuelektronowy:
molekułę H![]() . Aby wprowadzić jak najmniej zmian, zachowamy wszystko tak, jak było dla jonu H
. Aby wprowadzić jak najmniej zmian, zachowamy wszystko tak, jak było dla jonu H![]() (odległość, orbitale atomowe), a zmienimy tylko jedną rzecz: dodamy drugi elektron.
(odległość, orbitale atomowe), a zmienimy tylko jedną rzecz: dodamy drugi elektron.
Zobaczmy, jak wygląda teraz sprawa wiązania chemicznego. W tym przypadku mamy do dyspozycji kilka podejść przybliżonych. Na przykład jednym z tych podejść jest przybliżenie orbitali molekularnych, w którym funkcję
stanu podstawowego przedstawiamy w postaci wyznacznika złożonego ze spinorbitali. W innym podejściu funkcja falowa może mieć postać funkcji Heitlera-Londona, w której podkreśla się, że gdy pierwszy elektron jest przy jądrze ![]() , drugi jest przy jądrze
, drugi jest przy jądrze ![]() i na odwrót. Oba te podejścia prowadzą do powstania wiązania chemicznego, ale każde z nich nieco inaczej to powstanie opisuje.
i na odwrót. Oba te podejścia prowadzą do powstania wiązania chemicznego, ale każde z nich nieco inaczej to powstanie opisuje.
Weźmy najpierw metodę orbitali molekularnych. W metodzie tej funkcja falowa proponowana jest w postaci wyznacznika
w którym spinorbitale
Biorąc pod uwagę, że w rozpatrywanym przez nas najprostszym przypadku
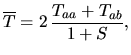 |
a zmiana średniej energii kinetycznej elektronów w H
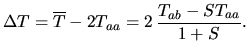 |
Korzystając podobnie jak poprzednio z tego, że funkcje
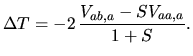 |
Wynik ten jest dwa razy większy od uzyskanego w przypadku H
Średnią wartość energii potencjalnej obliczymy jako
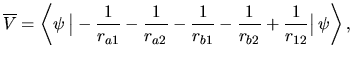 |
a po scałkowaniu po spinach jako
Po podstawieniu rozwinięcia LCAO dostajemy
a po odjęciu
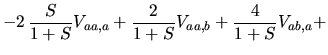 |
|||
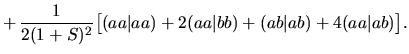 |
Zmiana energii całkowitej prowadzi do dokładnego kasowania członów występujących w
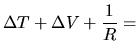 |
||
Dwa ostatnie człony, tzn.

Oznaczają one odpowiednio oddziaływanie ładunku elektronowego na atomie
![]() pomniejszonego o ładunek, który spłynął na środek wiązania,
sumarycznie:
pomniejszonego o ładunek, który spłynął na środek wiązania,
sumarycznie:
![]() , z jądrem
, z jądrem ![]() i na odwrót (te dwa przyczynki są równe) oraz oddziaływanie ładunku, który spłynął na
środek wiązania z atomu
i na odwrót (te dwa przyczynki są równe) oraz oddziaływanie ładunku, który spłynął na
środek wiązania z atomu ![]() , z jądrem
, z jądrem ![]() i na odwrót (znowu równe wkłady, razem
i na odwrót (znowu równe wkłady, razem
![]() ). Summa summarum można powiedzieć, że
wiązanie chemiczne powstaje z tej samej przyczyny, co w H
). Summa summarum można powiedzieć, że
wiązanie chemiczne powstaje z tej samej przyczyny, co w H![]() ,
i jest tym silniejsze (ładunek na środku wiązania większy), im większa całka nakrywania
,
i jest tym silniejsze (ładunek na środku wiązania większy), im większa całka nakrywania ![]() .
.
W klasycznym podejściu (całkowita gęstość elektronowa jest wtedy
sumą nienaruszonych gęstości atomowych) zbliżanie się dwóch atomów wodoru prowadziłoby do powstania oddziaływań: elektronu przy atomie ![]() z jądrem
z jądrem ![]() , elektronu przy atomie
, elektronu przy atomie ![]() z jądrem
z jądrem ![]() , jąder ze sobą i elektronów (każdy przy ,,swoim'' jądrze) ze sobą, co odpowiada:
, jąder ze sobą i elektronów (każdy przy ,,swoim'' jądrze) ze sobą, co odpowiada:
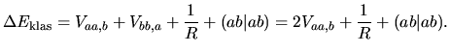 |
Widać, że obraz klasyczny różni się od obrazu kwantowego bardzo istotnie. Odpychanie elektronów staje się jednakowe w obu obrazach dopiero wtedy, gdy ![]() (wówczas
(wówczas ![]() ,
, ![]() ).
).
Przypadek H![]() w obrazie Heitlera-Londona
w obrazie Heitlera-Londona
Obraz molekuły wodoru uzyskany metodą orbitali molekularnych jest ułomny. Ułomność ta przeradza się w poważną chorobę dla dużych odległości międzyatomowych (które co prawda nie są takie istotne dla wiązań chemicznych). Może się to nie podobać i można zaproponować
funkcję falową Heitlera-Londona1![]() 2 dla molekuły wodoru. To właśnie od propozycji tej funkcji falowej zaczęła się chemia kwantowa:
2 dla molekuły wodoru. To właśnie od propozycji tej funkcji falowej zaczęła się chemia kwantowa:
Taka funkcja będzie nadal ułomna (tylko inaczej), ale dla dużej odległości międzyatomowej będzie bardzo dobra. Obliczamy, tak jak poprzednio3,
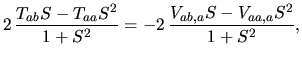 |
|||
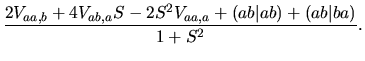 |
Zmiana energii całkowitej jest sumą tych dwóch składników i członu odpychania międzyjądrowego
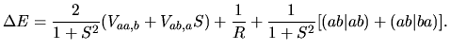 |
(2) |
Jest to wynik bardzo podobny do wyniku uzyskanego dla przybliżenia orbitali molekularnych. Różni się on
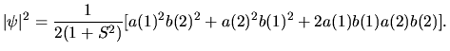 |
Gęstość prawdopodobieństwa znalezienia elektronu nr
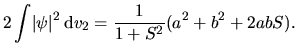 |
Człon
Uzyskany przez nas wzór (2) opisujący
![]() można więc zinterpretować tak, że oba jądra i oba elektrony się odpychają (ostatnie trzy człony), a to, co wiąże molekułę, to przyciąganie chmury elektronowej jednego atomu przez przeciwne jądro (pierwszy człon) oraz przyciąganie chmury elektronowej, która spłynęła z jądra na środek wiązania, przez przeciwne jądro
(drugi człon). Klasyczne wyrażenie na oddziaływanie dwóch atomów wodoru
można więc zinterpretować tak, że oba jądra i oba elektrony się odpychają (ostatnie trzy człony), a to, co wiąże molekułę, to przyciąganie chmury elektronowej jednego atomu przez przeciwne jądro (pierwszy człon) oraz przyciąganie chmury elektronowej, która spłynęła z jądra na środek wiązania, przez przeciwne jądro
(drugi człon). Klasyczne wyrażenie na oddziaływanie dwóch atomów wodoru
![]() w swoich członach ujemnych miałoby oddziaływanie jądra z całym ładunkiem elektronu na przeciwnym jądrze.
w swoich członach ujemnych miałoby oddziaływanie jądra z całym ładunkiem elektronu na przeciwnym jądrze.

- ... Heitlera-Londona1
- Biografie tych uczonych podane są w rozdz. 10 podręcznika.
- ...
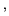 2
2
- Będzie ona omówiona w rozdz. 10 podręcznika.
- ... poprzednio3
- Rezultat sumowania po zmiennych spinowych jest taki sam jak wtedy, gdy w funkcji falowej pominiemy całkowicie jej część spinową
 .
.






