ROZDZIAŁ 14. SUPLEMENT 1
PRZYKŁAD PRZECIĘCIA STOŻKOWEGO: UKŁAD DH2
Plik pdf do wydruku: r14_supl1.pdf
Dogodny układ współrzędnych dla przecięcia stożkowego (PS)
Zainteresujmy się stanem podstawowym i pierwszym
stanem wzbudzonym układu dwóch protonów, jednego jądra deuteru i trzech elektronów.
Jedynym powodem, dla którego wprowadziłem tu deuter jest to, że reakcja D![]() H
H
![]() DH
DH![]() H wygląda sensowniej niż
H
H wygląda sensowniej niż
H![]() H
H
![]() H
H![]() H. Należy jednak dodać, że to ostatnie równanie też może odpowiadać realnej reakcji chemicznej i ma sens w kinetyce, podczas gdy w termodynamice (buchalterii chemicznej) oczywiście go nie ma1.
Stany wyżej wzbudzone takiego układu mogłyby wyglądać bardzo ciekawie, ale my ograniczymy się do tego, że każdy atom dysponuje jednym orbitalem atomowym i to typu
H. Należy jednak dodać, że to ostatnie równanie też może odpowiadać realnej reakcji chemicznej i ma sens w kinetyce, podczas gdy w termodynamice (buchalterii chemicznej) oczywiście go nie ma1.
Stany wyżej wzbudzone takiego układu mogłyby wyglądać bardzo ciekawie, ale my ograniczymy się do tego, że każdy atom dysponuje jednym orbitalem atomowym i to typu ![]() . Robimy tak dlatego,
że chcemy uchwycić esencję dwóch najniższych energetycznie stanów. Stopni swobody mamy
. Robimy tak dlatego,
że chcemy uchwycić esencję dwóch najniższych energetycznie stanów. Stopni swobody mamy
![]() i wprowadzamy układ
i wprowadzamy układ ![]() współrzędnych: atom
współrzędnych: atom ![]() jest zawsze w początku układu współrzędnych, atom
jest zawsze w początku układu współrzędnych, atom ![]() ma współrzędne
ma współrzędne
![]() ,
atom
,
atom ![]() ma współrzędne
ma współrzędne
![]() . Teraz zmieniamy układ współrzędnych na
. Teraz zmieniamy układ współrzędnych na
![]() ,
,
![]() ,
,
![]() . Zmiana (rys. 1)
sprowadza się do tego, że
. Zmiana (rys. 1)
sprowadza się do tego, że
![]() jest zawsze równe odległości
jest zawsze równe odległości ![]() , czyli
, czyli ![]() , a współrzędne
, a współrzędne ![]() ,
, ![]() atomu
atomu
![]() odczytujemy od specjalnego punktu na płaszczyźnie
odczytujemy od specjalnego punktu na płaszczyźnie ![]() , a mianowicie od wierzchołka trójkąta równobocznego o boku
, a mianowicie od wierzchołka trójkąta równobocznego o boku
![]()
(![]() ).
).
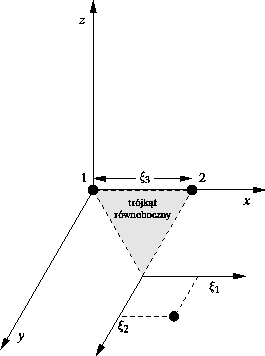
| Rys. 1. Nowy układ współrzędnych |
Przybliżona topografia hiperpowierzchni
Nowe współrzędne opisują wszystkie możliwe pozycje atomów ![]() ,
, ![]() i
i ![]() względem siebie. Jakie będą energie
względem siebie. Jakie będą energie ![]() i
i ![]() ? Na to pytanie odpowiedzi mogą dostarczyć konkretne obliczenia,
polegające na rozwiązaniu równania Schrödingera na siatce punktów w przestrzeni
? Na to pytanie odpowiedzi mogą dostarczyć konkretne obliczenia,
polegające na rozwiązaniu równania Schrödingera na siatce punktów w przestrzeni
![]() ,
, ![]() ,
,
![]() i na podaniu dla każdego takiego punktu energii najniższego stanu (
i na podaniu dla każdego takiego punktu energii najniższego stanu (![]() ) i pierwszego stanu wzbudzonego
(
) i pierwszego stanu wzbudzonego
(![]() ). Można jednak ,,czystym rozumem'' przewidzieć jakościowo, co
można uzyskać z obliczeń dla niektórych z tych punktów. Przede wszystkim łatwiej się zorientujemy po wykonaniu przekrojów
). Można jednak ,,czystym rozumem'' przewidzieć jakościowo, co
można uzyskać z obliczeń dla niektórych z tych punktów. Przede wszystkim łatwiej się zorientujemy po wykonaniu przekrojów
![]() i
i ![]() dla konkretnych wartości
dla konkretnych wartości ![]() . Możemy na przykład zacząć od
. Możemy na przykład zacząć od
![]() j.at., to jest odległości zbliżonej do odległości równowagi dla molekuły wodoru w stanie podstawowym.
Na rysunku 2 zostały zaznaczone takie punkty, w których możemy jakoś
ocenić wartości energii.
j.at., to jest odległości zbliżonej do odległości równowagi dla molekuły wodoru w stanie podstawowym.
Na rysunku 2 zostały zaznaczone takie punkty, w których możemy jakoś
ocenić wartości energii.
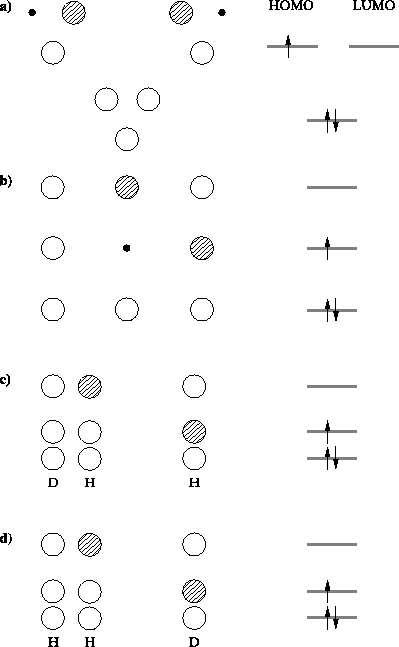
|
Rys. 2. Orbitale molekularne (po lewej) i obsadzenie elektronami poziomów orbitalnych (po prawej) dla układu DH |
a)
![]() ,
,
![]()
Konfiguracja trójkąta równobocznego (rys. 2a) o boku równym
![]() j.at.
Schemat poziomów orbitalnych jest nad wyraz
ciekawy2. Jest degeneracja poziomu HOMO i LUMO, w wyniku czego
j.at.
Schemat poziomów orbitalnych jest nad wyraz
ciekawy2. Jest degeneracja poziomu HOMO i LUMO, w wyniku czego
![]() . Próba zmiany
. Próba zmiany
![]() lub/i
lub/i
![]() powoduje natychmiast rozszczepienie HOMO i LUMO, co prowadzi do zróżnicowania
powoduje natychmiast rozszczepienie HOMO i LUMO, co prowadzi do zróżnicowania
![]() i
i ![]() : energia
: energia ![]() się obniża, a energia
się obniża, a energia ![]() podwyższa. Natomiast
podwyższa. Natomiast
![]() możemy zmieniać bezkarnie: jeśli
możemy zmieniać bezkarnie: jeśli
![]() i
i
![]() , to zawsze
, to zawsze
![]() ! Jest to więc przecięcie stożkowe hiperpowierzchni
! Jest to więc przecięcie stożkowe hiperpowierzchni ![]() i
i ![]() . Tak jak to było mówione (p. 6.10.1 w podręczniku), PS następuje w przestrzeni
. Tak jak to było mówione (p. 6.10.1 w podręczniku), PS następuje w przestrzeni
![]() -wymiarowej i tym wymiarem jest współrzędna
-wymiarowej i tym wymiarem jest współrzędna ![]() ! Dla różnych wartości
! Dla różnych wartości
![]() rozchylenie stożka jest inne: dla dużych
rozchylenie stożka jest inne: dla dużych
![]() stożki są bardzo rozwarte, dla małych
stożki są bardzo rozwarte, dla małych
![]() - bardzo wąskie.
- bardzo wąskie.
b)
![]() ,
,
![]() ,
,
![]()
Konfiguracja liniowa (rys. 2b). Atom ![]() znajduje się dokładnie
w środku odcinka
znajduje się dokładnie
w środku odcinka
![]() . Ponieważ odległości
. Ponieważ odległości ![]() i
i ![]() (rzędu
(rzędu ![]() j.at.) są bardzo małe, odpowiada tej konfiguracji bardzo wysoka energia
j.at.) są bardzo małe, odpowiada tej konfiguracji bardzo wysoka energia ![]() i jeszcze wyższa
i jeszcze wyższa ![]() .
.
c)
![]() ,
,
![]() ,
,
![]()
Atom ![]() współliniowy i bardzo daleko od molekuły DH (rys. 2c). Ten punkt odpowiada produktom reakcji.
współliniowy i bardzo daleko od molekuły DH (rys. 2c). Ten punkt odpowiada produktom reakcji.
d) Sytuacja (kolinearna) substratów reakcji (rys. 2d): deuter daleko od H![]() odpowiada dużej wartości
odpowiada dużej wartości ![]() , np.
, np. ![]() ,
, ![]() oraz
oraz
![]() . Dostajemy z tego:
. Dostajemy z tego:
![]() ,
,
![]() ,
,
![]() . Ten punkt odpowiada
substratom reakcji.
. Ten punkt odpowiada
substratom reakcji.
Dla ![]() w sytuacji: molekuła H
w sytuacji: molekuła H![]() i w dużej odległości od niej ustawiony atom deuteru (hiperpowierzchnie są
jednakowe dla DH
i w dużej odległości od niej ustawiony atom deuteru (hiperpowierzchnie są
jednakowe dla DH![]() i H
i H![]() ), dookoła H
), dookoła H![]() powinniśmy uzyskać
płytką fosę energii (rys. 3) o różnej głębokości i o dnie mniej więcej w kształcie elipsoidy bliskiej
kuli3.
powinniśmy uzyskać
płytką fosę energii (rys. 3) o różnej głębokości i o dnie mniej więcej w kształcie elipsoidy bliskiej
kuli3.
Skąd to wiadomo? Jasne, że przy dużej odległości H![]() i D
przyciągają się głównie siłami dyspersyjnymi.
Gdy więc atom deuteru zbliża się z daleka do molekuły,
energia się obniża niezależnie od kierunku zbliżania. Przy mniejszych odległościach energia musi się podwyższać z powodu zakazu Pauliego swobodnego przebywania trzech elektronów w tej samej części przestrzeni
(tak można opisać rezultat antysymetryzacji funkcji falowej). Mamy więc fosę. Skąd wiem, że jest zbliżona do kuli? Oddziaływanie dyspersyjne jest oddziaływaniem słabym, ten atom deuteru nie ma szans zbliżyć się
bardzo. Patrzy na molekułę wodoru o długości równowagowej
i D
przyciągają się głównie siłami dyspersyjnymi.
Gdy więc atom deuteru zbliża się z daleka do molekuły,
energia się obniża niezależnie od kierunku zbliżania. Przy mniejszych odległościach energia musi się podwyższać z powodu zakazu Pauliego swobodnego przebywania trzech elektronów w tej samej części przestrzeni
(tak można opisać rezultat antysymetryzacji funkcji falowej). Mamy więc fosę. Skąd wiem, że jest zbliżona do kuli? Oddziaływanie dyspersyjne jest oddziaływaniem słabym, ten atom deuteru nie ma szans zbliżyć się
bardzo. Patrzy na molekułę wodoru o długości równowagowej
![]() j.at. z daleka, powiedzmy 6 j.at. Ten, kto widział powierzchnię van der Waalsa molekuły H
j.at. z daleka, powiedzmy 6 j.at. Ten, kto widział powierzchnię van der Waalsa molekuły H![]() , wie, że jest ona podobna do kuli! I dlatego fosa jest niemal kulista. Najniższa energia
, wie, że jest ona podobna do kuli! I dlatego fosa jest niemal kulista. Najniższa energia ![]() naszego układu leży gdzieś w tej fosie. Oprócz fosy tylko jeszcze substraty i produkty mają niską energię, energia trzech atomów w innych konfiguracjach może być tylko wyższa. Aby przedostać się od substratów do produktów, musimy przejść jakoś przez ten obszar energii wysokich.
Wybieramy ,,najmniejsze zło'', czyli poszukujemy przełęczy. Ta przełęcz leży gdzieś między PS a kolinearnym punktem siodłowym.
naszego układu leży gdzieś w tej fosie. Oprócz fosy tylko jeszcze substraty i produkty mają niską energię, energia trzech atomów w innych konfiguracjach może być tylko wyższa. Aby przedostać się od substratów do produktów, musimy przejść jakoś przez ten obszar energii wysokich.
Wybieramy ,,najmniejsze zło'', czyli poszukujemy przełęczy. Ta przełęcz leży gdzieś między PS a kolinearnym punktem siodłowym.
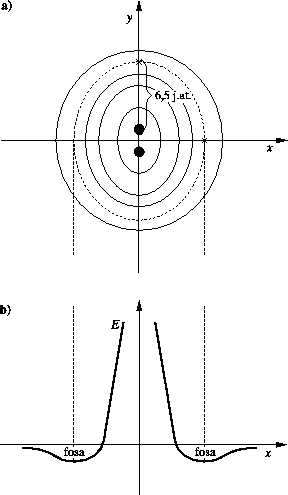
| Rys. 3. Fosa energetyczna dla atomu deuteru zbliżającego się do
H |
Dokładna topografia hiperpowierzchni
Przydałyby się jakieś liczby, aby mieć wyobrażenie,
o jakie energie i jakie geometrie tu chodzi. Odpowiedzi na wszystkie pytania o energię
![]() można znaleźć w publikacji A. I. Boothroyda i in.4, w której podano najdokładniejsze aktualnie wyniki dla hiperpowierzchni stanu podstawowego, otrzymane najbardziej wyrafinowanymi technikami obliczeniowymi. Podam kilka wyników dotyczących wspomnianej fosy. Otóż fosa jest najgłębsza w konfiguracji kolinearnej (energia ok.
można znaleźć w publikacji A. I. Boothroyda i in.4, w której podano najdokładniejsze aktualnie wyniki dla hiperpowierzchni stanu podstawowego, otrzymane najbardziej wyrafinowanymi technikami obliczeniowymi. Podam kilka wyników dotyczących wspomnianej fosy. Otóż fosa jest najgłębsza w konfiguracji kolinearnej (energia ok.
![]() kcal/mol dla odległości
kcal/mol dla odległości ![]() j.at. od
środka H
j.at. od
środka H![]() ), a płytsza dla konfiguracji w kształcie litery T (
), a płytsza dla konfiguracji w kształcie litery T (![]() kcal/mol dla odległości
kcal/mol dla odległości ![]() j.at. od środka). Podane energie obliczane są względem energii układu: izolowany atom wodoru
j.at. od środka). Podane energie obliczane są względem energii układu: izolowany atom wodoru ![]() izolowana molekuła
H
izolowana molekuła
H![]() ,
która to energia względem trzech izolowanych atomów wodoru (to będziemy dalej przyjmować za zero energii) wynosi ok.
,
która to energia względem trzech izolowanych atomów wodoru (to będziemy dalej przyjmować za zero energii) wynosi ok.![]() kcal/mol.
Widać, że minimum van der Waalsa odpowiada, zgodnie z oczekiwaniem
(patrz wyżej), bardzo małej energii wiązania (
kcal/mol.
Widać, że minimum van der Waalsa odpowiada, zgodnie z oczekiwaniem
(patrz wyżej), bardzo małej energii wiązania (![]() w porównaniu z
w porównaniu z
![]() kcal/mol).
kcal/mol).
Przecięcie stożkowe znalezione przez wymienionych autorów to rodzina trójkątów równobocznych, zgodnie z naszym wcześniejszym wyprowadzeniem.
Nie tylko rozchylenie, ale i energia odpowiadająca PS zależy od wartości
![]() . Istotnie, dla PS z bardzo dużym bokiem trójkąta
(równobocznego) energia
. Istotnie, dla PS z bardzo dużym bokiem trójkąta
(równobocznego) energia ![]() to prawie suma energii
to prawie suma energii ![]() atomów wodoru,
dla mniejszych trójkątów równobocznych występuje lekkie przyciąganie dyspersyjne, energia się więc obniża, dla całkiem małych trójkątów mamy już silne odpychanie.
atomów wodoru,
dla mniejszych trójkątów równobocznych występuje lekkie przyciąganie dyspersyjne, energia się więc obniża, dla całkiem małych trójkątów mamy już silne odpychanie.

Cytowani autorzy znaleźli to PS: trójkąt równoboczny ma wtedy bok
![]() j.at., a energia samego czubka PS jest równa ok.
j.at., a energia samego czubka PS jest równa ok.
![]() kcal/mol
(względem energii trzech izolowanych atomów wodoru), czyli wysoka w porównaniu z energią substratów (równą energii produktów) wynoszącą
kcal/mol
(względem energii trzech izolowanych atomów wodoru), czyli wysoka w porównaniu z energią substratów (równą energii produktów) wynoszącą
![]() kcal/mol. Autorzy znaleźli prawie dokładnie stożkowy spadek energii w pobliżu PS, tak jak wynikło z naszej analizy.
kcal/mol. Autorzy znaleźli prawie dokładnie stożkowy spadek energii w pobliżu PS, tak jak wynikło z naszej analizy.
Przy ograniczeniu się tylko do konfiguracji liniowych najniższą energię
obserwuje się we wspomnianym minimum van der Waalsa. Dalsze zbliżanie się atomu wodoru podwyższa energię ![]() . W pewnym momencie odległości każdego z atomów do atomu centralnego się zrównują. Energia takiego symetrycznego układu jest wysoka, ale można zapytać, przy jakiej odległości będzie ona
najniższa5. Stanie się to w kolinearnym punkcie
siodłowym, w którym ta odległość
wynosi
. W pewnym momencie odległości każdego z atomów do atomu centralnego się zrównują. Energia takiego symetrycznego układu jest wysoka, ale można zapytać, przy jakiej odległości będzie ona
najniższa5. Stanie się to w kolinearnym punkcie
siodłowym, w którym ta odległość
wynosi
![]() j.at. a energia
j.at. a energia
![]() j.at., czyli ok.
j.at., czyli ok.
![]() kcal/mol (względem energii trzech izolowanych atomów wodoru).
Zwróćmy uwagę, że jest to ok.
kcal/mol (względem energii trzech izolowanych atomów wodoru).
Zwróćmy uwagę, że jest to ok. ![]() kcal/mol wyżej niż energia substratów
(lub produktów) i dużo niżej niż szczyt PS.
kcal/mol wyżej niż energia substratów
(lub produktów) i dużo niżej niż szczyt PS.
Reakcje termochemiczne i fotochemiczne
Aby dojść od substratów do produktów reakcji
po dolnej hiperpowierzchni
(czyli termochemicznie), musimy być w pobliżu PS. Nie dostaniemy się
dokładnie do PS, czyli do punktu
![]() ,
,
![]() , bo to jest maksimum
, bo to jest maksimum ![]() . Innymi słowy, poruszając się po hiperpowierzchni
. Innymi słowy, poruszając się po hiperpowierzchni ![]() ,
przechodzimy w pobliżu
,
przechodzimy w pobliżu ![]() , ale jej nie dotykamy, co jest
podobne do nieprzecinania się takich hiperpowierzchni.
Mimo więc, że hiperpowierzchnie się przecinają, na drodze reakcji
(odbywającej się na dolnej hiperpowierzchni) się nie przecinają, a bariera reakcji wynika z przechodzenia obok PS.
, ale jej nie dotykamy, co jest
podobne do nieprzecinania się takich hiperpowierzchni.
Mimo więc, że hiperpowierzchnie się przecinają, na drodze reakcji
(odbywającej się na dolnej hiperpowierzchni) się nie przecinają, a bariera reakcji wynika z przechodzenia obok PS.
Jeśli reakcja przebiega fotochemicznie, to zostaje wykorzystany przy tym
sam punkt PS, który można traktować wtedy jak drzwi do innego
świata: ze świata pierwszego stanu wzbudzonego do świata stanu podstawowego. Okazuje się, że jeśli obliczenia PS prowadzimy dla innych molekuł, to napotykamy sytuację bardzo podobną do opisanej dla H![]() :
konfiguracja PS odpowiada często ustawieniu trzech atomów w trójkącie zbliżonym do równobocznego. Taką sytuację można (w obliczeniach teoretycznych) sprowokować przez umieszczenie wybranych uprzednio trzech atomów w bliskiej od siebie odległości przy użyciu brutalnej siły, tzn.
przez przemieszczenie ich wbrew wszelkim wiązaniom z innymi atomami. Wtedy,
oczywiście, jedziemy ostro w górę z
:
konfiguracja PS odpowiada często ustawieniu trzech atomów w trójkącie zbliżonym do równobocznego. Taką sytuację można (w obliczeniach teoretycznych) sprowokować przez umieszczenie wybranych uprzednio trzech atomów w bliskiej od siebie odległości przy użyciu brutalnej siły, tzn.
przez przemieszczenie ich wbrew wszelkim wiązaniom z innymi atomami. Wtedy,
oczywiście, jedziemy ostro w górę z ![]() , ale gdzieś tam wysoko jest stan wzbudzony
, ale gdzieś tam wysoko jest stan wzbudzony ![]() naszego układu, dla którego taki zabieg jest korzystny energetycznie, bo np. tworzy molekułę trójatomową z tych trzech atomów. Stan
naszego układu, dla którego taki zabieg jest korzystny energetycznie, bo np. tworzy molekułę trójatomową z tych trzech atomów. Stan ![]() zjeżdża więc w dół. Oba stany się
spotykają i mamy PS! Takich PS możemy mieć wiele
zjeżdża więc w dół. Oba stany się
spotykają i mamy PS! Takich PS możemy mieć wiele![]() .
.
- ... ma1
- Hiperpowierzchnie energii potencjalnej dla ruchu jąder w obu przypadkach byłyby identyczne. Różnica byłaby tylko w stanach rotacyjno-oscylacyjnych z powodu różnych mas atomów wodoru i deuteru.
- ... ciekawy2
- Wynika to z grupy symetrii trójkąta równobocznego. W sytuacji molekuły o kształcie wielokąta foremnego i oferowania przez każdy atom jednego orbitalu atomowego poziomy energetyczne otrzymuje się także z następującej reguły. Ustaw molekułę symetrycznie na sztorc na jednym z atomów. Wtedy atomy wskazują (w pewnej skali energii) poziomy i ich degenerację.
- ... kuli3
- Fosa pokazałaby się w całej krasie, gdyby zrobić przekrój energii jako funkcji położenia deuteru w przestrzeni i następnie wykreślić energię jako funkcję położenia deuteru w tym przekroju.
- ... in.4
-
A. I. Boothroyd, W. J. Keogh, P. G. Martin, M. R. Peterson, J. Chem. Phys.,
 .
.
- ... najniższa5
-
Jeśli nasz liniowy układ oznaczyć przez D H H
 , to chodzi o równe odległości DH i HH
, to chodzi o równe odległości DH i HH .
.






