Jądrowy rezonans magnetyczny
Badania białek za pomocą rentgenowskiej analizy strukturalnej wspomagane są obecnie przez technikę jądrowego rezonansu magnetycznego (NMR). NMR, w odróżnieniu od rentgenowskich badań prowadzonych na kryształach, pozwala na poznanie trójwymiarowej struktury białek w środowisku bardziej zbliżonym do naturalnego, czyli w roztworach. Ważną zaletą NMR jest także fakt, że ta technika spektroskopowa posługuje się promieniowaniem elektromagnetycznym o stosunkowo niskich energiach od około 1,7·10-7 eV do około 3,7·10-6 eV. Ten przedział energii odpowiada falom radiowym o częstościach z zakresu 40-900 MHz. Stosowanie promieniowania elektromagnetycznego o tak niskiej energii w najmniejszym stopniu nie naraża struktury białka na uszkodzenie. Możliwość wygenerowania defektów strukturalnych w badanym białku jest natomiast jednym z podstawowych mankamentów rentgenowskiej analizy strukturalnej wykorzystującej wysokoenergetyczne promieniowanie X.
Metoda NMR wykorzystuje fakt, że część atomów z których zbudowane jest białko wykazuje magnetyzm jądrowy. W szczególności, jądra atomowe zawierające nieparzystą liczbę protonów lub neutronów obdarzone są niezerowym momentem pędu 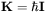 , gdzie
, gdzie 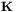 oznacza moment pędu,
oznacza moment pędu, 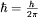 , a
, a 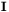 jest spinem jądrowym. Jądra takie wykazują zatem niezerowy moment magnetyczny
jest spinem jądrowym. Jądra takie wykazują zatem niezerowy moment magnetyczny 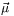 , który może być wyrażony wzorem
, który może być wyrażony wzorem 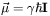 , gdzie
, gdzie 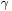 oznacza czynnik giromagnetyczny dla danego jądra. Jeżeli taki układ spinów jądrowych umieścimy w silnym zewnętrznym polu magnetycznym
oznacza czynnik giromagnetyczny dla danego jądra. Jeżeli taki układ spinów jądrowych umieścimy w silnym zewnętrznym polu magnetycznym 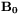 , nastąpi uporządkowanie jądrowych momentów magnetycznych wzdłuż kierunku pola. Zgodnie z jednym z podstawowych praw fizyki (doświadczenie Sterna i Gerlacha z 1923 r.), momenty magnetyczne jąder ustawią się "równolegle" albo "antyrównolegle" do kierunku pola. Dla jąder atomów wodoru 1H (protonów), o jądrowym spinie
, nastąpi uporządkowanie jądrowych momentów magnetycznych wzdłuż kierunku pola. Zgodnie z jednym z podstawowych praw fizyki (doświadczenie Sterna i Gerlacha z 1923 r.), momenty magnetyczne jąder ustawią się "równolegle" albo "antyrównolegle" do kierunku pola. Dla jąder atomów wodoru 1H (protonów), o jądrowym spinie 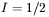 , będzie to odpowiadało dwóm wartościom magnetycznej liczby kwantowej
, będzie to odpowiadało dwóm wartościom magnetycznej liczby kwantowej 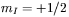 oraz
oraz 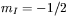 . W ogólności, w zewnętrznym polu magnetycznym, poziomy energetyczne jąder rozszczepiają się na
. W ogólności, w zewnętrznym polu magnetycznym, poziomy energetyczne jąder rozszczepiają się na 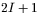 podpoziomów różniących się energią
podpoziomów różniących się energią 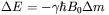 , gdzie
, gdzie 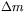 odpowiada różnicy wartości odpowiednich magnetycznych liczb kwantowych
odpowiada różnicy wartości odpowiednich magnetycznych liczb kwantowych 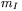 . Pojawienie się przerwy energetycznej
. Pojawienie się przerwy energetycznej 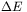 między poziomami o różnych jądrowych liczbach magnetycznych w zewnętrznym polu magnetycznym nosi nazwę jądrowego zjawiska Zeemana, a odpowiednie poziomy zwane są poziomami zeemanowskimi. W określonych warunkach doświadczalnych jądrowy układ poziomów zeemanowskich może absorbować energię dostarczoną z zewnątrz. Takie warunki doświadczalne stosowane są właśnie w technice NMR do detekcji jąder atomowych obdarzonych niezerowym spinem. Kwantowy obraz zjawiska jądrowego rezonansu magnetycznego dla najprostszego przypadku (dla jąder atomów wodoru, 1H) przedstawiono na rys. 23.
między poziomami o różnych jądrowych liczbach magnetycznych w zewnętrznym polu magnetycznym nosi nazwę jądrowego zjawiska Zeemana, a odpowiednie poziomy zwane są poziomami zeemanowskimi. W określonych warunkach doświadczalnych jądrowy układ poziomów zeemanowskich może absorbować energię dostarczoną z zewnątrz. Takie warunki doświadczalne stosowane są właśnie w technice NMR do detekcji jąder atomowych obdarzonych niezerowym spinem. Kwantowy obraz zjawiska jądrowego rezonansu magnetycznego dla najprostszego przypadku (dla jąder atomów wodoru, 1H) przedstawiono na rys. 23.
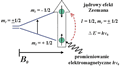
Rysunek 23. Kwantowy obraz zjawiska jądrowego rezonansu magnetycznego
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Próbka zawierająca protony umieszczona jest w polu 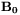 . Jeśli układ taki naświetlimy dodatkowo promieniowaniem elektromagnetycznym o częstotliwości
. Jeśli układ taki naświetlimy dodatkowo promieniowaniem elektromagnetycznym o częstotliwości 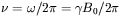 i o składowej magnetycznej
i o składowej magnetycznej 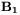 spolaryzowanej w płaszczyźnie prostopadłej do pola zewnętrznego (
spolaryzowanej w płaszczyźnie prostopadłej do pola zewnętrznego (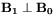 oraz
oraz 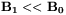 ), to wywołane zostaną przejścia pomiędzy sąsiednimi poziomami zeemanowskimi. Dla układu protonów (1H) o jądrowym spinie
), to wywołane zostaną przejścia pomiędzy sąsiednimi poziomami zeemanowskimi. Dla układu protonów (1H) o jądrowym spinie 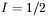 dla dozwolonego przejścia
dla dozwolonego przejścia 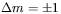 , warunek jądrowego rezonansu magnetycznego można wyrazić zależnością
, warunek jądrowego rezonansu magnetycznego można wyrazić zależnością 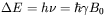 . Jeśli taki układ protonów zostanie zanurzony w polu magnetycznym o natężeniu 1 T, to rezonansowa częstość promieniowania elektromagnetycznego wyniesie 42,58 MHz. Jest to zatem częstość z zakresu fal radiowych, nieco tyko niższa od pasma UKF.
. Jeśli taki układ protonów zostanie zanurzony w polu magnetycznym o natężeniu 1 T, to rezonansowa częstość promieniowania elektromagnetycznego wyniesie 42,58 MHz. Jest to zatem częstość z zakresu fal radiowych, nieco tyko niższa od pasma UKF.
Informacja strukturalna w metodzie NMR pochodzi z precyzyjnego pomiaru tzw. przesunięcia chemicznego (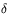 ), które jest silnie zróżnicowane dla poszczególnych atomów wodoru lub ich ugrupowań w danym białku. Przesunięcie chemiczne jest miarą niewielkich różnic natężenia pola magnetycznego "wyczuwanego" przez dane jądro atomowe. Małe lokalne zmiany natężenia pola magnetycznego na poszczególnych jądrach atomowych są wynikiem ich ekranowania przez chmury elektronowe danego atomu i jego najbliższych sąsiadów. W wyniku takiego ekranowania efektywne pole magnetyczne w miejscu obserwowanego jądra jest nieco inne niż pole zewnętrzne. Stopień ekranowania, a więc i przesunięcie chemiczne dla danego jądra zależne są zatem od lokalnego rozkładu gęstości elektronów wokół niego. Prowadzi to do zróżnicowania częstości rezonansowych (
), które jest silnie zróżnicowane dla poszczególnych atomów wodoru lub ich ugrupowań w danym białku. Przesunięcie chemiczne jest miarą niewielkich różnic natężenia pola magnetycznego "wyczuwanego" przez dane jądro atomowe. Małe lokalne zmiany natężenia pola magnetycznego na poszczególnych jądrach atomowych są wynikiem ich ekranowania przez chmury elektronowe danego atomu i jego najbliższych sąsiadów. W wyniku takiego ekranowania efektywne pole magnetyczne w miejscu obserwowanego jądra jest nieco inne niż pole zewnętrzne. Stopień ekranowania, a więc i przesunięcie chemiczne dla danego jądra zależne są zatem od lokalnego rozkładu gęstości elektronów wokół niego. Prowadzi to do zróżnicowania częstości rezonansowych (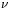 ) dla poszczególnych grup jąder i w rezultacie, przy ustalonym polu
) dla poszczególnych grup jąder i w rezultacie, przy ustalonym polu 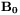 , w widmie NMR ich linie różnią się położeniem na osi częstości. Odległość danej linii od umownej linii wzorca odpowiada właśnie przesunięciu chemicznemu i może być zapisane w postaci:
, w widmie NMR ich linie różnią się położeniem na osi częstości. Odległość danej linii od umownej linii wzorca odpowiada właśnie przesunięciu chemicznemu i może być zapisane w postaci: 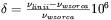 .
.
Przesunięcie chemiczne mierzone jest w jednostkach względnych (ppm) w stosunku do wzorcowej substancji, którą najczęściej jest tetrametylosilan (CH3)4Si, w skrócie TMS. Przykładowe widmo NMR zarejestrowane dla próbki zawierającej roztwór alkoholu etylowego (C2H5OH) w wodzie pokazano na rys. 24.
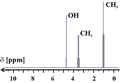
Rysunek 24. Widmo NMR protonów (1H) dla roztworu alkoholu etylowego w wodzie (pole magnetyczne 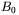 = 4,7 T, częstość
= 4,7 T, częstość 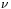 ~ 200 MHz). Wartość
~ 200 MHz). Wartość 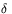 odpowiada położeniu linii rezonansowej wzorca (TMS)
odpowiada położeniu linii rezonansowej wzorca (TMS)
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Widmo NMR prostego związku chemicznego jakim jest C2H5OH zawiera trzy wyraźnie rozdzielone zespoły linii, które pochodzą od protonów znajdujących się w grupach CH3, CH2 i OH. Widmo to ilustruje podstawową zaletę metody NMR: jej wysoką zdolność rozdzielczą. Na osi poziomej wykresu odłożone jest przesunięcie chemiczne, które dla poszczególnych grup protonów wynosi odpowiednio: 1, 3,6 oraz 4,7 ppm. Należy zwrócić uwagę na to, że rozszczepienie linii w ramach grup jest wynikiem dodatkowego oddziaływania, zwanego sprzężeniem spinowo-spinowym (dla różnych kombinacji oddziałujących ze sobą spinów jądrowych). Stosunek całkowitych natężeń linii NMR (rozumianych jako suma pól powierzchni linii w ramach danej grupy) dla protonów z grup CH3, CH2 i OH wynosi odpowiednio 3 : 2 : 1, co dobrze odzwierciedla różnicę liczby protonów przynależnych do poszczególnych grup.
Dla bardziej skomplikowanych cząsteczek organicznych, pomiar przesunięcia chemicznego jest wygodnym sposobem badania ich struktury. Przykładowo, dla protonów grupy metylowej (-CH3), 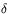 często wynosi ok. 1 ppm w stosunku do wartości ok. 7 ppm dla protonów związanych z pierścieniem aromatycznym. Przesunięcie chemiczne dla większości jąder wodoru w białkach zawiera się pomiędzy 1 i 9 ppm. Dodatkowo, położone w pobliżu siebie jądra atomów wodoru mogą ze sobą oddziaływać magnetycznie w wyniku wspomnianego już wyżej sprzężenia typu spin-spin. Takie oddziaływanie, pomiędzy nierównoważnymi często jądrami atomów wodoru, występuje dla jąder blisko położonych, gdy ich wzajemna odległość nie jest większa niż trzy wiązania kowalencyjne. W wypadku pomiarów NMR molekuł białek oddziaływania spinowo-spinowe dostarczają dodatkowych ważnych informacji strukturalnych.
często wynosi ok. 1 ppm w stosunku do wartości ok. 7 ppm dla protonów związanych z pierścieniem aromatycznym. Przesunięcie chemiczne dla większości jąder wodoru w białkach zawiera się pomiędzy 1 i 9 ppm. Dodatkowo, położone w pobliżu siebie jądra atomów wodoru mogą ze sobą oddziaływać magnetycznie w wyniku wspomnianego już wyżej sprzężenia typu spin-spin. Takie oddziaływanie, pomiędzy nierównoważnymi często jądrami atomów wodoru, występuje dla jąder blisko położonych, gdy ich wzajemna odległość nie jest większa niż trzy wiązania kowalencyjne. W wypadku pomiarów NMR molekuł białek oddziaływania spinowo-spinowe dostarczają dodatkowych ważnych informacji strukturalnych.
W badaniach NMR struktury niektórych białek wykorzystuje się także inne stabilne izotopy, takie jak, np. 13C, 14N, 31P oraz 17O. Istotne z punktu widzenia NMR własności izotopów pierwiastków najczęściej występujących w białkach zestawiono w tabeli 4.
Z danych zamieszczonych w tab. 4 wynika, że przy ustalonym polu magnetycznym o natężeniu 1 T najwyższą częstość rezonansową obserwuje się dla jąder atomów wodoru (1H). Protony odznaczają się bowiem największym współczynnikiem giromagnetycznym spośród wszystkich stabilnych izotopów pierwiastków występujących w białkach. W związku z tym, że czułość detekcji sygnału NMR rośnie wraz ze wzrostem momentu magnetycznego oraz biorąc pod uwagę fakt, że wodór jest jednym z głównych składników białek, rezonans jądrowy wodoru 1H jest najszerzej stosowany w strukturalnych badaniach białek.
Badania struktury białek za pomocą metody NMR napotykają na naturalną trudność wynikającą ze złożonej struktury molekuł białka. Widma protonowe dla większych cząsteczek białka w roztworach mogą być niezwykle skomplikowane (nakładanie się wielu linii). Do niedawna zakładano, że metoda NMR najlepiej nadaje się do badań strukturalnych białek nie przekraczających 40 kDa. Począwszy od lat 70-tych, wraz z rozwojem technologii wytwarzania wysokich pól magnetycznych w nadprzewodzących solenoidach, nastąpiło wyraźne polepszenie rozdzielczości i czułości metody NMR. Tendencja do przeprowadzania pomiarów NMR w polach magnetycznych o coraz wyższych natężeniach stale się utrzymuje i współczesne spektrometry NMR wykorzystują pola magnetyczne sięgające do ok. 21,5 T (odpowiadające im częstości rezonansowe są bliskie 900 MHz). Schemat typowego spektrometru NMR przedstawiono na Rys. 25.
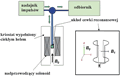
Rysunek 25. Uproszczony schemat współczesnego spektrometru NMR. Badana próbka białka w postaci roztworu wodnego umieszczona jest w polu magnetycznym 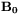 . Dodatkowe pole o częstości radiowej i o składowej magnetycznej
. Dodatkowe pole o częstości radiowej i o składowej magnetycznej 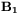 prostopadłej do pola
prostopadłej do pola 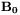 wytwarzane jest przez układ cewki rezonansowej (w powiększeniu)
wytwarzane jest przez układ cewki rezonansowej (w powiększeniu)
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Znaczną poprawę czułości spektrometrów NMR uzyskano także dzięki wprowadzeniu wielokrotnego zapisu widm (tzw. akumulacja widm) oraz szerokiemu zastosowaniu metod impulsowych (techniki tzw. echa spinowego wspomagane obróbką sygnału NMR za pomocą transformaty Fouriera). Milowym krokiem w wykorzystaniu techniki NMR do analizy strukturalnej białek było pojawienie się w latach 80-tych metody dwuwymiarowej spektroskopii NMR (2D NMR). Należy tu zaznaczyć, że w klasycznym eksperymencie NMR widma rejestrowane są przy jednym zmiennym parametrze. Jest nim na ogół zmienna częstość promieniowania elektromagnetycznego doprowadzana do badanej próbki (przy ustalonej wartości pola magnetycznego 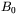 ). Możliwa jest jednak rejestracja widm NMR przy dwu zmiennych lecz skorelowanych ze sobą parametrach. Ten drugi parametr (np. dodatkowe promieniowanie o częstości radiowej) pozwala na znacznie lepsze wykorzystanie zdolności rozdzielczej metody NMR. W szczególności do badań struktury białek stosuje się obecnie metodę 2D NMR opartą o tzw. jądrowy efekt Overhausera (w skrócie NOESY). Metoda ta wykorzystuje mechanizm wzajemnego przekazu energii między układami jąder biorących udział w rezonansie (tzw. jądra "rezonansowe") i układem jąder aktualnie niepobudzanych (tzw. jądra "nierezonansowe"). W technice NOESY stosuje się dodatkowe naświetlenie jąder "nierezonansowych" słabym promieniowaniem o odpowiednio dobranej częstości. Jest to oczywiście częstość rezonansowa dla tej grupy jąder, różna jednak od częstości pobudzającej rezonans głównej grupy jąder "rezonansowych". W wyniku oddziaływań dipolowych energia pobudzenia z grupy jąder "nierezonasowych" przenosi się do grupy jąder "rezonansowych" (tzw. relaksacja skrośna). Za pomocą techniki NOESY można wyznaczać odległości międzyatomowe wykorzystując fakt, że szybkość relaksacji skrośnej zależy od odległości między oddziałującymi ze sobą dipolami jądrowymi jak r-6, gdzie r oznacza odległość międzyatomową. Technika NOESY umożliwia zatem określenie trójwymiarowych struktur białek w roztworach.
). Możliwa jest jednak rejestracja widm NMR przy dwu zmiennych lecz skorelowanych ze sobą parametrach. Ten drugi parametr (np. dodatkowe promieniowanie o częstości radiowej) pozwala na znacznie lepsze wykorzystanie zdolności rozdzielczej metody NMR. W szczególności do badań struktury białek stosuje się obecnie metodę 2D NMR opartą o tzw. jądrowy efekt Overhausera (w skrócie NOESY). Metoda ta wykorzystuje mechanizm wzajemnego przekazu energii między układami jąder biorących udział w rezonansie (tzw. jądra "rezonansowe") i układem jąder aktualnie niepobudzanych (tzw. jądra "nierezonansowe"). W technice NOESY stosuje się dodatkowe naświetlenie jąder "nierezonansowych" słabym promieniowaniem o odpowiednio dobranej częstości. Jest to oczywiście częstość rezonansowa dla tej grupy jąder, różna jednak od częstości pobudzającej rezonans głównej grupy jąder "rezonansowych". W wyniku oddziaływań dipolowych energia pobudzenia z grupy jąder "nierezonasowych" przenosi się do grupy jąder "rezonansowych" (tzw. relaksacja skrośna). Za pomocą techniki NOESY można wyznaczać odległości międzyatomowe wykorzystując fakt, że szybkość relaksacji skrośnej zależy od odległości między oddziałującymi ze sobą dipolami jądrowymi jak r-6, gdzie r oznacza odległość międzyatomową. Technika NOESY umożliwia zatem określenie trójwymiarowych struktur białek w roztworach.
Spektroskopia NMR wraz z metodą dyfrakcji promieniowania X są jedynymi technikami pozwalającymi wyznaczyć przestrzenną strukturę białka z rozdzielczością "atomową". Bez wątpienia, metody rentgenowskiej analizy strukturalnej, w szczególności z wykorzystaniem promieniowania synchrotronowego, dostarczają danych strukturalnych o najwyższej precyzji. Wymagają jednak, tak jak wspomniano wyżej, wyhodowania wysokiej jakości kryształów białka, co często jest bardzo poważnym utrudnieniem. W tych wypadkach właśnie metoda NMR jest bardzo pomocna, zwłaszcza gdy uda się przygotować roztwory białka o dużym stężeniu (przykładowo: ok. 10-3 mol/l dla białka o masie molekularnej ok. 15 kDa). Białka o dużej masie molekularnej stanowią jednak ciągle poważne wyzwanie dla badań za pomocą NMR, gdyż rozdzielczość tej metody znacznie się pogarsza dla białek o masie przekraczającej 40 kDa.





