Rentgenowska analiza strukturalna
Dyfrakcja promieni rentgenowskich dostarcza informacji o trójwymiarowej strukturze tych białek, które udało się zidentyfikować, wyizolować, a następnie wyhodować ich kryształy odpowiednio dobrej jakości. Jednym z pierwszych białek, które udało się otrzymać w formie wysokiej jakości kryształów oraz zbadać za pomocą dyfrakcji promieni rentgenowskich była insulina (1924 r.). Dzięki znajomości trójwymiarowej struktury przestrzennej oraz poznaniu sekwencji aminokwasów w tym białku (1958 r.), insulina była też pierwszym ludzkim białkiem, które udało się otrzymać drogą całkowicie syntetyczną (1979 r.). Nastąpiło to więc na długo przed poznaniem odpowiedniej sekwencji nukleotydów kodujących insulinę w ludzkim genomie. Zakres badań prowadzonych za pomocą techniki rentgenowskiej stale się powiększa. Poza prostymi białkami w postaci krystalicznej, bada się także duże asocjaty białek, np. rybosomy, białkowy rdzeń nukleosomu, kompleksy białko-białko (w szczególności białko-przeciwciało) lub też kompleksy białko-DNA.
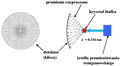
Rysunek 20. Schemat aparatury stosowanej w rentgenowskiej analizie strukturalnej. Naświetlona klisza (lewa strona rysunku) przedstawia tzw. lauegram dla monokryształu hemoglobiny
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Odkryte przez Roentgena w 1895 r. promieniowanie X wytwarzane jest obecnie w lampach rentgenowskich. W lampach takich następuje termoemisja elektronów z katody. Są one następnie przyspieszane w obszarze między katodą i anodą za pomocą wysokiego napięcia (~100 kV). Elektrony o tak dużej energii bombardują anodę, a źródłem promieniowania X są radiacyjne przejścia pomiędzy wewnętrznymi powłokami elektronowymi atomów wchodzących w skład materiału anody. Długości fal emitowanych przez lampy rentgenowskie zawierają się w przedziale od 10-11 do 10-9 m (0,01-1 nm). W szczególności, charakterystyczne promieniowanie rentgenowskie o długości fali ~ 10-10 m znajduje zastosowanie w analizie strukturalnej, gdyż typowe odległości międzyatomowe zarówno w ciałach stałych, jaki i w kryształach białek, są właśnie tego rzędu (~ 0,1 nm). W praktyce wykorzystuje się najczęściej promieniowanie rentgenowskie o długościach fal od 0,02 do 0,25 nm, co odpowiada energiom z przedziału od 60 do 5 keV.
Rozdzielczość rentgenowskiej analizy strukturalnej stale się poprawia i pozwala na precyzyjne określenie położeń zdecydowanej większości atomów w danej molekule białka. Dla wielu wykrystalizowanych białek rozdzielczość ta jest lepsza niż 0,2 nm, co odpowiada prawie połowie długości wiązania peptydowego. Coraz częściej do badań strukturalnych białek używane jest promieniowanie synchrotronowe wytwarzane w postaci silnie koherentnej wiązki o bardzo dużym natężeniu. Typowy rozkład widmowy źródła promieniowania synchrotronowego pokazany jest na rys. 21. W odróżnieniu od klasycznych lamp rentgenowskich, źródła synchrotronowe wytwarzają promieniowanie elektromagnetyczne o bardzo szerokim spektrum, pokrywając zakres od podczerwieni, poprzez zakres promieniowania widzialnego i ultrafioletu próżniowego, aż po tzw. miękkie i twarde promieniowanie X. Tak szeroki zakres promieniowania odpowiada przedziałowi energii od ok. 0,1 eV do ok. 1000 keV. Należy zwrócić uwagę na znacznie wyższe natężenie wiązki oraz na szerszy zakres widmowy promieniowania synchrotronowego w porównaniu z tradycyjnymi źródłami promieniowania elektromagnetycznego. Praktycznie w całym swym dostępnym zakresie natężenie promieniowania synchrotronowego jest kilka rzędów wielkości wyższe niż otrzymywane za pomocą innych źródeł promieniowania, włączywszy w to klasyczną lampę generującą promieniowanie rentgenowskie.
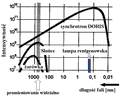
Rysunek 21. Rozkład widmowy źródła promieniowania synchrotronowego dla synchrotronu Doris (Double-Ring Storage Device) w ośrodku Deutches Elektronen - Synchrotron (DESY) w Hamburgu. Intensywność promieniowania jest tu rozumiana jako liczba fotonów wyemitowanych w określonym kącie bryłowym w czasie jednej sekundy
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Promieniowanie synchrotronowe wytwarzane jest w pierścieniowych akceleratorach naładowanych cząstek, takich jak elektrony lub pozytony. W systemach tych cząstki poruszają się w bardzo wysokiej próżni po orbitach kołowych o średnicach rzędu kilkudziesięciu metrów z prędkościami bliskimi prędkości światła. Zakrzywienie toru elektronów możliwe jest dzięki zastosowaniu pól magnetycznych o silnym natężeniu (polega to na wykorzystaniu siły Lorenza zakrzywiającej tor naładowanej cząstki poruszającej się w kierunku prostopadłym do linii sił pola magnetycznego). Na przykład, w synchrotronie DORIS, o końcowej energii elektronów rzędu 5,6 GeV, dla zakrzywiania toru elektronów stosowane jest pole magnetyczne o natężeniu 1 T. Ze względu na zamkniętą trajektorię ruchu naładowanych cząstek w synchrotronie pierścieniowym, elektrony doznają przyspieszenia dośrodkowego, któremu towarzyszy wypromieniowanie energii elektromagnetycznej. Maksymalna energia wyemitowanego promieniowania, Emax, związana jest z promieniem krzywizny orbity i można ją wyrazić wzorem: 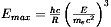 , gdzie me oznacza masę elektronu, h — stałą Plancka, c — prędkość światła, E — energię wiązki, zaś R opowiada promieniowi krzywizny trajektorii elektronów. Jak wynika z powyższej zależności, dla promienia krzywizny około kilkudziesięciu metrów i energii wiązki ok. kilku GeV, wypromieniowana energia Emax wynosi ok. kilkudziesięciu keV.
, gdzie me oznacza masę elektronu, h — stałą Plancka, c — prędkość światła, E — energię wiązki, zaś R opowiada promieniowi krzywizny trajektorii elektronów. Jak wynika z powyższej zależności, dla promienia krzywizny około kilkudziesięciu metrów i energii wiązki ok. kilku GeV, wypromieniowana energia Emax wynosi ok. kilkudziesięciu keV.
Zastosowanie takich źródeł promieniowania o natężeniu wiązki około trzy rzędy wielkości większej niż w tradycyjnych wysokonapięciowych lampach rentgenowskich pozwala na znaczne skrócenie czasu wykonywania analizy dyfrakcyjnej kryształów białka. Dzięki dużej jasności i silnej zbieżności wiązki promieniowania X wytwarzanej w źródłach synchrotronowych, możliwe jest także otrzymywanie informacji kinetycznych. Analiza rentgenowska pozwala więc na wykonywanie eksperymentów krystalografii rozdzielczej w czasie. Technika ta umożliwia przeprowadzanie bezpośredniej analizy strukturalnej przejściowych struktur białka w procesach dynamicznych w warunkach temperaturowych zbliżonych do temperatury fizjologicznej. Tego typu podejście pozwala na otrzymanie informacji o dynamicznych zmianach struktur konformacji białka z dokładnością około 0,18 nm, z rozdzielczością czasową rzędu 1 ns. Na rys. 22 przedstawiono wynik doświadczenia, w którym śledzono zmiany konformacji molekuły mioglobiny w procesie odłączania się od niej cząsteczki tlenku węgla (CO). Proces ten zapoczątkowany został impulsem laserowym, który dostarczył wzbudzenia elektronowego grupie prostetycznej mioglobiny (żelazo-protoporfiryna). W wyniku tego wzbudzenia, molekuła CO dysocjuje, a proces ten może być śledzony w czasie rzeczywistym. Poszczególne etapy procesu śledzone były w odstępach czasu 150 ps odpowiadających pojedynczym rozbłyskom promieniowania synchrotronowego. Całkowity proces dysocjacji następował w czasie dziesięć razy dłuższym.






