Struktura elektronowa C60
Wysoka symetria C60 powoduje degenerację poziomów elektronowych. Absorpcja promieniowania w zakresie widzialnym i nadfiolecie zachodzi w wyniku przejść elektronowych z najwyższych obsadzonych orbitali — kolejno: gg8, hg10, hu10 do najniższych nieobsadzonych orbitali — kolejno: t1u, t1g, hg. Najniższe energetycznie przejście hu![]() t1u (HOMO-LUMO), o energii 1,9 eV jest zabronione ze względu na symetrię orbitali, przejścia hu
t1u (HOMO-LUMO), o energii 1,9 eV jest zabronione ze względu na symetrię orbitali, przejścia hu![]() t1g, hg
t1g, hg![]() t1u, hu
t1u, hu![]() hg, gg
hg, gg![]() t2u, hg
t2u, hg![]() t2u są pierwszymi optycznie dozwolonymi.
t2u są pierwszymi optycznie dozwolonymi.
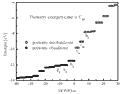
Rysunek 4. Energie orbitali molekularnych izolowanej molekuły C60 obliczone w przybliżeniu Hückel'a
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Roztwór C60 w heksanie ma kolor purpurowy, w rozpuszczalnikach aromatycznych, takich jak benzen czy toluen — czerwony, a w metylonaftalenie (C11H10) nawet brązowy. Absorpcja promieniowania w obszarze 200-470 nm wynika z dozwolonych, a powyżej 470 nm z zabronionych elektronowych przejść optycznych. Zabronione przejścia optyczne są aktywowane przez wibracje C60 i oddziaływanie z innymi molekułami, np. rozpuszczalnika. Zmiana barwy w zależności od rozpuszczalnika świadcząca o przesunięciu absorpcji do niższych energii wynika z uaktywniania przejść zabronionych przez oddziaływanie molekuł rozpuszczalnika z C60 i obniżenia jego symetrii.
Pasma energetyczne fulerytu wynikają z niewielkiego przekrycia orbitali molekularnych, pasmo walencyjne jest utworzone z obsadzonych poziomów hu, a pasmo przewodnictwa — z pustych t1u. Gęstość stanów w fulerytach prawie bezpośrednio można obserwować w pomiarach fotoemisji i odwrotnej fotoemisji elektronów, w których maksima prądu w funkcji energii wiązane są ze stanami molekularnymi; pomiary te dowodzą słabego oddziaływania molekuł w kryształach fulerytu.
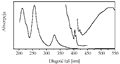
Rysunek 5. Absorpcja optyczna C60 w roztworze n-heksanu w obszarze widzialnym i nadfiolecie, z pracy S. Leacha i współpracowników. Kolejne krzywe przy większych długościach fal rejestrowane były przy dłuższej drodze optycznej w roztworze C60
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Przerwa energetyczna ekstrapolowana z tych pomiarów wynosi 2,6 eV, z pomiarów elektrycznych ok. 1,5 eV, natomiast w pomiarach optycznych obserwuje się szeroką krawędź absorpcji w zakresie 1,5-1,8 eV. Przerwa energetyczna obliczona metodą LDA (Local Density Approximation) wynosi ok. 1,5 eV i jest porównywalna z wartością obliczoną dla izolowanej molekuły C60. Fuleren C60 jest dobrym akceptorem elektronów. Własności akceptorowe fulerenów wynikają z krzywizny powierzchni uniemożliwiającej pełną hybrydyzację sp2 i wprowadzającej pewien udział hybrydyzacji sp3, a więc wiązań nienasyconych. W anionie C60-1 nadmiarowy elektron zajmuje orbitalnie potrójnie zdegenerowany stan t1u. Możliwość wielokrotnej jonizacji C60 aż do stanu -6 obserwowano metodą cyklowoltametrii w elektrolicie CH2Cl2 z dodatkiem 0,1 M Bu4N+BF4-. W tych doświadczeniach obserwuje się oscylacyjny charakter zmian prądu w funkcji przyłożonego napięcia, który świadczy o zmianie stopnia jonizacji fulerenów.





