Odkrycie i struktura fulerenów
Fulereny są — obok grafitu i diamentu — trzecią alotropową odmianą węgla. Nazwa obejmuje całą rodzinę cząsteczek, o ogólnym wzorze C2n (n ≥ 16), w których atomy węgla położone są tylko na powierzchni bryły. Fulereny odkryto w 1985 r. podczas badań klasterów węgla wytwarzanych przez odparowanie grafitu za pomocą lasera i studzeniu par węgla w atmosferze helu. W takich doświadczeniach obserwowano już wcześniej, że klastery o masach cząsteczkowych odpowiadających 60 i 70 atomom węgla występują częściej niż inne klastery o zbliżonej liczbie atomów. H.W. Kroto, R.E. Smalley i R.F. Curl zaproponowali przestrzenną strukturę klasterów 60-atomowych wyjaśniającą ich trwałość. Według tej hipotezy cząsteczka C60 zbudowana jest z fragmentu zwiniętej płaszczyzny grafitowej, w której każdy z tworzących ją atomów ma 3 najbliższych sąsiadów (atomy tworzą strukturę wzajemnie połączonych sześciokątów). Deformacja płaszczyzny grafitowej do zamkniętej powierzchni wymaga przebudowy 12 sześciokątów na pięciokąty. Powstaje wtedy wielościan foremny — dwudziestościan (ikosaedr) ścięty o symetrii grupy punktowej Ih z 20 sześciokątnymi i 12 pięciokątnymi ścianami bocznymi (rys.1).
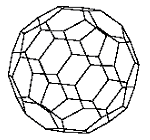
Rysunek 1. Struktura przestrzenna fulerenu C60. Wyróżnione jest wiązanie pojedyncze na krawędzi pięciokąt-sześciokąt i podwójne na krawędzi sześciokąt-sześciokąt
Wprowadzenie 12 pięciokątów pozwala na utworzenie powierzchni bryły z dowolnej liczby atomów (powyżej 20) z zachowaniem liczby najbliższych sąsiadów. W C60 wszystkie atomy węgla znajdują się w równoważnych pozycjach w wierzchołkach ikosaedru ściętego. Dwa typy krawędzi wielościanu — między pięciokątami i sześciokątami oraz pomiędzy dwoma sześciokątami — wskazują na różne wiązania C-C utworzone przez 4 (2s22p2) elektrony walencyjne atomu węgla o hybrydyzacji głównie typu sp2. Trzy elektrony tworzą wiązania typu σ, czwarty elektron — wiązania typu π z trzema najbliższymi atomami. Istnienie pięciokątów powoduje osłabienie wiązań chemicznych w tym obszarze. Uważa się, że trwałe są fulereny z izolowanymi pięciokątami. Cząsteczka C60 mogłaby mieć inną budowę niż proponowana, wtedy jednak pięciokąty nie byłyby izolowane, a to zwiększyłoby reaktywność cząsteczki i zmniejszyło jej trwałość. C60 jest najmniejszym fulerenem, w którym pięciokąty nie mają wspólnej krawędzi, kolejnym fulerenem z izolowanymi pięciokątami jest C70. Metodą spektroskopii masowej zaobserwowano cząsteczki od C32 do C960, wyizolowano jednak tylko C36, C60, C70, C76, C82, C84. W przypadku cząsteczek mniejszych niż C60 pięciokąty muszą mieć wspólne krawędzie — takie fulereny są reaktywne. Udało się jednak wyizolować cząsteczki C36 o symetrii D6h, a nawet wytworzyć z nich kryształy. Wielościan o liczbie wierzchołków mniejszej od 60 może być zbudowany na wiele sposobów, dlatego np. C40 może występować w postaci 40 równie trwałych izomerów; w przypadku większych fulerenów można znaleźć różne struktury zapewniające izolację pięciokątów, np. możliwe jest istnienie 35 izomerów C88. Struktura fulerenu została potwierdzona badaniami dyfrakcyjnymi po odkryciu efektywnej metody wytwarzania fulerenów. Przedstawienie hipotezy dotyczącej budowy przestrzennej C60 (po jej potwierdzeniu) przyniosło odkrywcom Nagrodę Nobla w dziedzinie chemii w 1996 r. Nazwa fuleren (w literaturze angielskiej niekiedy buckminsterfullerene) pochodzi od nazwiska amerykańskiego architekta, projektanta kopuł geodezyjnych Richarda Buckminstera Fullera.
Rysunek 2. Fulereny, od lewej: C60, C70, C80, C180, C240, C540
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W badaniach jądrowego rezonansu magnetycznego 13C NMR w roztworach C60 obserwuje się tylko jedną linię rezonansową, co dowodzi, że położenia wszystkich atomów węgla są równoważne, a przesunięcie chemiczne δ = 142,7 ppm wskazuje, że wiązania chemiczne mają taki charakter, jak wiązania w cząsteczkach związków aromatycznych. Badania magnetycznego sprzężenia dipolowego 13C - 13C metodą NMR w ciele stałym (na próbkach wzbogaconych do 6% w izotop 13C) potwierdziły istnienie w C60 dwóch typów wiązań, które można przypisać sześćdziesięciu krawędziom pięciokąt-sześciokąt o długości d5-6 =1,45 ± 0,01 Å i trzydziestu krawędziom między sześciokątami d6-6 =1,40 ± 0,01 Å, które odpowiadają wiązaniu pojedynczemu i podwójnemu. Średnica molekuły obliczona z wyznaczonych odległości C-C wynosi 0,71 ± 0,007 nm. Występowanie różnych wiązań (d5-6 i d6-6) prowadzi do niejednorodnej gęstości elektronów na powierzchni C60.





