Wpływ ciśnienia na właściwości materiałów
Równanie stanu
gęstość Głównym efektem działania ciśnienia na substancję jest zmniejszanie się jej objętości (ściśliwość). Zależność pomiędzy gęstością 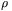 , temperaturą
, temperaturą 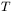 i ciśnieniem
i ciśnieniem 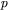 określa równanie stanu, które dla substancji chemicznie czystej ma postać
określa równanie stanu, które dla substancji chemicznie czystej ma postać 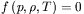 . W zależności od stanu skupienia zachodzi duży (dla fazy gazowej) bądź stosunkowo mały (dla fazy ciekłej i stałej) wpływ ciśnienia na objętość (gęstość) układu. Gęstość rośnie ze wzrostem ciśnienia, przy czym im większe jest przykładane ciśnienie, tym przyrost ten jest mniejszy.
. W zależności od stanu skupienia zachodzi duży (dla fazy gazowej) bądź stosunkowo mały (dla fazy ciekłej i stałej) wpływ ciśnienia na objętość (gęstość) układu. Gęstość rośnie ze wzrostem ciśnienia, przy czym im większe jest przykładane ciśnienie, tym przyrost ten jest mniejszy.
Dla większości cieczy prostych przebieg względnej zmiany objętości ze zmianą ciśnienia jest podobny (rys. 3a). Dlatego do opisu ich zachowania stosuje się uniwersalne zależności, tj. dla umiarkowanych ciśnień – równanie stanu Redlicha-Kwonga:
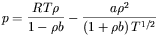
w którym 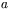 i
i 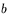 są stałymi, a dla bardzo wysokich ciśnień – bardziej dokładne równanie Benedicta-Webba-Rubina:
są stałymi, a dla bardzo wysokich ciśnień – bardziej dokładne równanie Benedicta-Webba-Rubina:
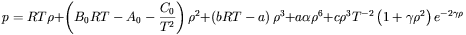
w którym wartości stałych (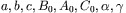 ) wynikają z dopasowania równania do danych eksperymentalnych. Natomiast znane równanie stanu Van der Waalsa:
) wynikają z dopasowania równania do danych eksperymentalnych. Natomiast znane równanie stanu Van der Waalsa: 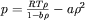 , służy tylko do jakościowego opisu zachowania cieczy w warunkach bardzo wysokiego ciśnienia. Wzrost gęstości zależy od rodzaju cieczy, np. dla ciśnienia 1 GPa wynosi 25% dla wody czy eteru, ale ok. 5% dla rtęci.
, służy tylko do jakościowego opisu zachowania cieczy w warunkach bardzo wysokiego ciśnienia. Wzrost gęstości zależy od rodzaju cieczy, np. dla ciśnienia 1 GPa wynosi 25% dla wody czy eteru, ale ok. 5% dla rtęci.
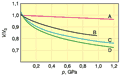
Rysunek 3a. Doświadczalnie wyznaczone krzywe zależności względnych zmian objętości (ΔV/V0) cieczy pod działaniem wysokiego ciśnienia (statycznego): A – dla rtęci w temperaturze 20°C, B – wody w temperaturze 50°C, C – alkoholu metylowego w temperaturze 20°C, D – eteru w temperaturze 20°C
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
W ciałach stałych przyłożenie umiarkowanego ciśnienia powoduje liniowe zmniejszenie objętości, określone objętościowym modułem ściśliwości 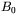 . Natomiast działanie bardzo wysokiego ciśnienia, powyżej 30 GPa powoduje nieliniowe zmniejszenie objętości, które wyznacza się najczęściej na podstawie pomiaru stałych sieciowych metodami rentgenowskimi. Nieliniowe zmiany objętości z ciśnieniem występują w przypadku ciśnienia o wartości rzędu ułamka modułu ściśliwości. Zależność objętości od ciśnienia opisywana jest przez fenomenologiczne równania stanu (rys. 3b), takie jak równanie Murnaghana:
. Natomiast działanie bardzo wysokiego ciśnienia, powyżej 30 GPa powoduje nieliniowe zmniejszenie objętości, które wyznacza się najczęściej na podstawie pomiaru stałych sieciowych metodami rentgenowskimi. Nieliniowe zmiany objętości z ciśnieniem występują w przypadku ciśnienia o wartości rzędu ułamka modułu ściśliwości. Zależność objętości od ciśnienia opisywana jest przez fenomenologiczne równania stanu (rys. 3b), takie jak równanie Murnaghana:
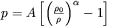 ,
,
lub Keane'a:
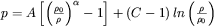 .
.
Kryształy z wiązaniami metalicznymi są na ogół mniej ściśliwe od kryształów molekularnych. Natomiast struktury łańcuchowe (parafina) czy warstwowe (grafit) wykazują znaczne zróżnicowanie ściśliwości w różnych kierunkach krystalograficznych. Z kolei silne wiązania kowalencyjne ograniczają możliwość zwiększenia gęstości pod wpływem ciśnienia – mimo małego współczynnika upakowania substancje te należą do najmniej ściśliwych, np. diament jest ponad 200 razy mniej ściśliwy niż cez. W przypadku bardzo wysokiego ciśnienia zmiany objętości stają się małe, co jest spowodowane usztywnieniem sieci. Z tym związane są również inne właściwości kryształów poddanych działaniu bardzo wysokiego ciśnienia, np. wzrost przewodnictwa cieplnego izolatorów.
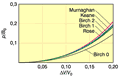
Rysunek 3b. Zależność względnych zmian objętości ciał stałych (ΔV/V0) od ciśnienia (statycznego) – porównanie różnych fenomenologicznych równań stanu
(aby obejrzeć powiększony rysunek, kliknij w miniaturkę)
Wielkości fizyczne związane z gęstością substancji, takie jak współczynnik ściśliwości izotermicznej 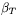 i współczynnik rozszerzalności termicznej
i współczynnik rozszerzalności termicznej 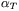 , maleją wraz ze wzrostem ciśnienia. W przypadku niskiego ciśnienia wielkości te różnią się znacznie dla różnych temperatur, natomiast dla wysokiego ciśnienia różnice te stają się małe.
, maleją wraz ze wzrostem ciśnienia. W przypadku niskiego ciśnienia wielkości te różnią się znacznie dla różnych temperatur, natomiast dla wysokiego ciśnienia różnice te stają się małe.
ciepło właściwe Ciepło właściwe substancji nie zmienia się w znaczący sposób w zakresie ciśnienia do 1 GPa. Z wartości 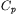 (ciepła właściwego pod stałym ciśnieniem), określonych na podstawie równania stanu dla różnych zakresów ciśnienia, wynika, że z reguły dla niższych ciśnień
(ciepła właściwego pod stałym ciśnieniem), określonych na podstawie równania stanu dla różnych zakresów ciśnienia, wynika, że z reguły dla niższych ciśnień 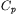 cieczy i gazów maleje pod wpływem ciśnienia, dla wyższych natomiast zaczyna rosnąć.
cieczy i gazów maleje pod wpływem ciśnienia, dla wyższych natomiast zaczyna rosnąć.





